
【题目】下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g)![]() 2H2O(l) △H=571.6 kJ/mol,则氢气的燃烧热为285.8 kJ/mol
2H2O(l) △H=571.6 kJ/mol,则氢气的燃烧热为285.8 kJ/mol
B.已知C(石墨,s)![]() C(金刚石,s) △H>0 ,则金刚石比石墨稳定
C(金刚石,s) △H>0 ,则金刚石比石墨稳定
C.含20.0 gNaOH稀溶液与稀盐酸完全中和,放出28.7 kJ热量,则稀醋酸和稀NaOH溶液反应热化学方程式为NaOH(aq) + CH3COOH(aq)![]() CH3COONa(aq) + H2O(1) △H=57.4 kJ/mol
CH3COONa(aq) + H2O(1) △H=57.4 kJ/mol
D.已知2C(s)+2O2(g)![]() 2CO2(g) △H1;2C(s)+O2(g)
2CO2(g) △H1;2C(s)+O2(g)![]() 2CO(g) △H2,则△H1>△H2
2CO(g) △H2,则△H1>△H2
科目:高中化学 来源: 题型:
【题目】以烃A为主要原料,采用以下路线合成药物X、Y和高聚物Z。

已知:I. (R或R可以是烃基或H原子)。
(R或R可以是烃基或H原子)。
II.反应①、反应②、反应⑤的原子利用率均为100%。
请回答下列问题:
(1)B的名称为______,X中的含氧官能团名称为________,反应③的条件为_____,反应④ 的反应类型是__________。
(2)关于药物Y ( )的说法正确的是(____)
)的说法正确的是(____)
A.药物Y的分子式为C8H8O4,遇氯化铁溶液可以发生显色反应
B. lmol药物Y与H2、浓溴水中的Br2反应,最多消耗H2、Br2分别为4 mol和2 mol
C. lmol 药物Y与足量的钠反应可以生成22.4L氢气
D.药物Y中⑥、⑦、⑧三处-OH的电离程度由大到小的顺序是⑧>⑥>⑦
(3)写出反应E→F的化学方程式__________。
(4)写出符合下列条件的E的所有同分异构体的结构简式_________。
① 属于酚类化合物,且是苯的对位二元取代物;② 能发生银镜反应和水解反应。
(5)设计一条以CH3CHO及CH3OH 为起始原料合成Z的线路(无机试剂及溶剂任选)。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:
(1)H3PO2与足量的NaOH溶液反应,生成NaH2PO2,则H3PO2为______ 元酸,其电离方程式是__________.
(2)H3PO2是中强酸,写出其与NaHCO3溶液反应的离子方程式______________________.
(3)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银.
①H3PO2中,P元素的化合价为__________;
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则其氧化产物为_____________;(填化学式)
(4)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于强弱电解质及非电解质的组合完全正确的是( )
A | B | C | D | |
强电解质 | NaCl | H2SO4 | CaCO3 | HNO3 |
弱电解质 | HF | BaSO4 | HClO | CH3COOH |
非电解质 | Cl2 | CO2 | H2S | SO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaN3+KNO3→N2↑+K2O+Na2O此方程式是汽车剧烈碰撞时,安全气囊中发生的反应。对上述反应的描述错误的是( )
A. NaN3是还原剂,KNO3是氧化剂
B. 该反应中有一种元素的化合价发生变化
C. 若生成8 mol N2,则转移电子的物质的量为5 mol
D. 配平后物质的系数依次为10、2、1、5、16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些科学家提出硅是“21世纪的能源”,下列有关硅及其化合物的说法正确的是
A. 硅在自然界中以游离态和化合态两种形式存在
B. 硅晶体是良好的半导体,可用于制造光导纤维
C. SiO2是酸性氧化物,不与任何酸发生反应
D. 木材浸过水玻璃后,不易着火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是 (填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
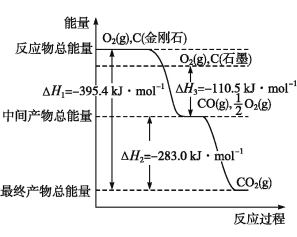
①在通常状况下,金刚石和石墨中 (填“金刚石”或“石墨”)更稳定,石墨的燃烧热为 。
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为 。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol1、497 kJ·mol1。
N2(g)+O2(g)![]() 2NO(g) ΔH=180.0 kJ·mol1。
2NO(g) ΔH=180.0 kJ·mol1。
NO分子中化学键的键能为 kJ·mol1。
(4)综合上述有关信息,请写出CO和NO反应的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷的一些化合物常用作半导体、除草剂、杀鼠药等。回答下列问题:
(1)基态As原子的核外电子排布式为[Ar]__________,有 ______个未成对电子。
(2)镓氮砷合金材料的太阳能电池效率达40%。Ga、N、As电负性由大至小的顺序是 ___________。
(3)As4O6的分子结构如图所示,其中As原子的杂化方式为 _____mol。AS4O6含有![]() 键的物质的量为_________mol。
键的物质的量为_________mol。

(4)As与N是同主族兀素,AsH3的沸点(-62.5 ℃)比NH3的沸点(-33.5℃)低,原因是______。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,根据结构与性质的关系,H3AsO4的酸性比
H3ASO3强的原因是_________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,LiZnAs基稀磁半导体的晶胞如图所示,其中原子坐标参数A处Li为(0,0,![]() );B处As为(
);B处As为(![]() ,
,![]() ,
,![]() );C处Li的坐标参数为__________。
);C处Li的坐标参数为__________。
②晶胞参数,描述晶胞的大小和形状,已知LiZnAs单晶的晶胞参数a = 594 pm,NA表示阿伏加德罗常数的数值,其密度为 ____g cm3 (列出计算式即可)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸的结构简式如下图,则下列有关绿原酸的说法不正确的是( )

A. 分子式为C16H1809
B. 既可以与氢气发生加成反应,又可以使酸性KMn04溶液褪色
C. 还能发生取代、加聚、消去等反应
D. 在镍做催化剂的情况下,1 mol绿原酸发生加成反应最多可消耗6 mol氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com