
| A. | 葡萄糖和蛋白质等高分子化合物是人体必需的营养物质 | |
| B. | 酸雨是指pH<7.0的雨水 | |
| C. | 居室中放置一盆石灰水可以吸收CO,预防中毒 | |
| D. | 用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应 |
分析 A.葡萄糖的相对分子质量在10000以下,不是高分子;
B.酸雨的pH<5.6;
C.CO与石灰水不反应;
D.过多二氧化碳排放,可加聚温室效应.
解答 解:A.葡萄糖的相对分子质量在10000以下,不是高分子,而蛋白质为高分子,葡萄糖和蛋白质均是人体必需的营养物质,故A错误;
B.酸雨的pH<5.6,酸雨中溶解了二氧化硫,酸性增强,故B错误;
C.CO与石灰水不反应,则放置一盆石灰水不能吸收CO,不能预防中毒,故C错误;
D.过多二氧化碳排放,可加聚温室效应,则用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应,故D正确;
故选D.
点评 本题考查环境问题及物质的性质,为高频考点,把握物质的性质、性质与应用、环境保护等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 分子式为C10H19O | |
| B. | 同分异构体可能属于醛类、酮类或酚类 | |
| C. | 能发生取代、氧化、还原反应 | |
| D. | 与氢气加成后的产物有4种一氯化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物与人类生产、生活息息相关.回答下列问题:
氮及其化合物与人类生产、生活息息相关.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
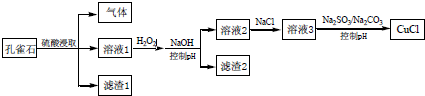
| A. | H2O2 将溶液1 中Fe2+氧化为Fe3+,再通过控制pH 转化为Fe(OH)3除去 | |
| B. | CO32-作用是控制溶液pH,促使CuCl 沉淀的生成 | |
| C. | SO32-将溶液3 中的Cu2+还原,反应得到CuCl | |
| D. | 若改变试剂加入顺序,将溶液3缓慢加入到含大量$\frac{S{O}_{3}^{2-}}{C{O}_{3}^{2-}}$的溶液中,同样可制取CuCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
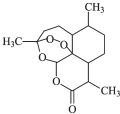 中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )| A. | 青蒿素分子式为C15H22O5 | |
| B. | 青蒿素含有“-O-O-”键具有较强的氧化性 | |
| C. | 青蒿素易发生加成反应和氧化反应 | |
| D. | 青蒿素在碱性条件下易发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3,3-二甲基-1-丁烯与1-己炔 | |
| B. | 3-甲基-2-乙基-2-戊烯与3-乙基庚烯 | |
| C. | 2-甲基-1,3-丁二烯与2-戊炔 | |
| D. | 2-己炔与2,3-二甲基-2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
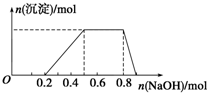 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,已知①该溶液的焰色反应没有黄色;②当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.由此可知:
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,已知①该溶液的焰色反应没有黄色;②当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.由此可知:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com