
下列能用勒沙特列原理解释的是()
①红棕色NO2加压后颜色先变深后变浅
②SO2催化氧化成SO3的反应,往往加入过量的空气
③Fe(SCN)3溶液中加入固体KSCN后颜色变深
④氯水宜保存在低温、避光条件下
⑤乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利.
A. ①②⑤ B. ②③④ C. ①②③⑤ D. 全部
考点: 化学平衡移动原理.
专题: 化学平衡专题.
分析: 平衡移动列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用平衡移动原理时,该反应必须是可逆反应,否则不适用平衡移动原理.
解答: 解:①加压二氧化氮的浓度增大,平衡向生成四氧化二氮的方向移动,故加压后颜色先变深后变浅,但仍比原来的颜色深,可用平衡移动原理解释,故正确;
②SO2催化氧化成SO3的反应,往往加入过量的空气能促使平衡正向移动,有利于三氧化硫的生成,可用平衡移动原理解释,故正确;
③向硫氰化铁溶液中加入硫氰化钾固体时,硫氰根离子浓度增大,平衡向正反应方向移动,则硫氰化铁浓度增大,溶液的颜色变深,可用平衡移动原理解释,故正确;
④存在Cl2+H2O⇌HCl+HClO,生成的次氯酸见光分解,促进平衡正向进行,故氯水宜保存在低温、避光条件下,能用勒夏特利原理解释,故正确;
⑤乙酸乙酯在碱性条件下,氢离子浓度变小,平衡正向,促进水解,而在酸性条件下氢离子浓度变大抑制水,能用勒夏特利原理解释,故正确;
故选D.
点评: 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
下列操作中,若以标准溶液滴定待测液,能造成中和滴定结果偏低的是()
A. 未用标准液润洗滴定管
B. 盛标准液的滴定管尖嘴部分有气泡未排出就开始滴定,滴定后气泡消失
C. 锥形瓶用蒸馏水洗,未用待测液润洗
D. 振荡时锥形瓶中液滴飞溅出来
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y是元素周期表中ⅦA族中的两种元素,下列叙述中能说明X的非金属性比Y强的是( )
|
| A. | X原子的电子层数比Y原子的电子层数多 |
|
| B. | X的氢化物的沸点比Y的氢化物沸点低 |
|
| C. | X的气态氢化物比Y的气态氢化物稳定 |
|
| D. | Y的单质能将X从NaX的溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应X(g)+Y(g)⇌2Z(g);△H<0,达到平衡时,下列说法正确的是()
A. 减小容器体积,平衡向右移动
B. 加入催化剂,Z的产率增大
C. 增大c(X),X的转化率增大
D. 降低温度,Y的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动,下列叙述正确的是()
①生成物的质量分数一定增加;②生成物的物质的量一定增加;
③反应物的转化率一定增大;④平衡时反应物的浓度一定降低;
⑤正反应速率一定大于逆反应速率;⑥一定使用了催化剂.
A. ①②⑤ B. ④⑥ C. ②⑤ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某可逆反应:mA(g)+nB(g)⇌xC(g),在密闭容器中进行,右图表示反应在不同时间t、温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则正确的是()
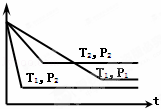
A. T1>T2,P1>P2,m+n>x,正反应放热
B. T1<T2,P1<P2,m+n<x,正反应吸热
C. T1>T2,P1<P2,m+n<x,正反应放热
D. T1<T2,P1>P2,m+n>x,正反应吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
已知汽车尾气无害化处理反应为2NO(g)+2CO(g)⇌N2(g)+2CO2(g),下列说法不正确的是()
A. 升高温度可使该反应的逆反应速率降低
B. 使用高效催化剂可有效提高正反应速率
C. 反应达到平衡后,NO的反应速率保持恒定
D. 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各离子浓度的大小比较,正确的是()
A. 同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH3•H2O,c(NH4+)由大到小的顺序是:①>③>②>④
B. 常温时,将等体积的盐酸和氨水混合后,pH=7,则c (NH4+)>c (Cl﹣)
C. 0.2 mol•L﹣1Na2CO3溶液中:c (OH﹣)=c (HCO3﹣)+c (H+)+c (H2CO3)
D. 0.01 mol•L﹣1的NH4Cl溶液与0.05mol•L﹣1的NaOH溶液等体积混合:c (Cl﹣)>c (NH4+)>c (Na+)>c (OH﹣)>c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
我国发射的“神舟五号”载人飞船的燃料是铝粉与高氯酸铵的混合物.点燃时,铝粉氧化放热引发高氯酸铵反应2NH4ClO4=N2↑+4H2O+Cl2↑+O2↑;△H<0.关于该反应叙述不正确的是()
A. 该反应属于分解反应、氧化还原反应、放热反应
B. 该反应瞬间能产生大量高温气体,推动飞船飞行
C. 从能量变化上看,该反应是化学能转变为热能和动能
D. 反应中NH4ClO4只起到氧化剂的作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com