
| A. | 将铁粉加入稀硫酸中:2Fe+6H+═Fe3++3H2↑ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 将氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 将铁屑加入Fe3+溶液中:Fe3++Fe═2Fe2+ |
分析 A.铁粉与稀硫酸反应生成硫酸亚铁和氢气;
B.四氧化三铁与盐酸反应生成亚铁离子和铁离子;
C.亚铁离子被稀硝酸氧化成铁离子;
D.离子方程式两边正电荷不相等,违反了电荷守恒.
解答 解:A.将铁粉加入稀硫酸中,反应生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故A错误;
B.将磁性氧化铁溶于盐酸,反应生成氯化亚铁和氯化铁,正确的离子方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O,故B错误;
C.将氯化亚铁溶液和稀硝酸混合,二者发生氧化还原反应,反应的离子方程式为:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑,故C正确;
D.将铁屑加入Fe3+溶液中,反应生成氯化亚铁,正确的离子方程式为:2Fe3++Fe═3Fe2+,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
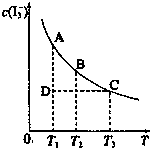 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I-3(aq).I2、KI混合溶液中,I-3的物质的量浓度c(I-3)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下到说法正确的组合是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I-3(aq).I2、KI混合溶液中,I-3的物质的量浓度c(I-3)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下到说法正确的组合是( )| A. | ②③ | B. | ②③⑤ | C. | ①④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CO2(g)═2CO(g)+O2(g)△H=+566.0 kJ•mol-1,则 CO(g)的燃烧热是-283.0kJ•mol-1 | |
| B. | H2SO4和NaOH反应的中和热△H=-57.3 kJ•mol-1,则1molH2SO4和1molBa(OH)2反应的反应热△H=-114.6kJ•mol-1 | |
| C. | 石墨转化为金刚石是吸热反应,可知金刚石的燃烧热更大 | |
| D. | 在恒温时,压缩容器的体积,则2SO2+O2?2SO3平衡正向移动,该反应的△H减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
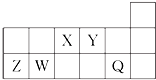
| A. | X与Y可以形成5种以上的化合物 | |
| B. | Y分别与Z、W形成的化合物的晶体类型相同 | |
| C. | 工业上常用电解法生产Z、Q的单质 | |
| D. | 简单气态氢化物的热稳定性:Y>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L醋酸 | B. | 0.5L 0.1mol/L H2SO4溶液 | ||
| C. | 1L 0.1mol/L盐酸 | D. | 2L 0.1mol/L H2SO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com