
| A. | 稀释溶液,$\frac{c(HC{O}_{3}^{-}C)•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$不变 | |
| B. | 通入CO2,溶液pH增大 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 加入NaOH固体,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 |
分析 A.水解平衡常数只与温度有关;
B.通入CO2,发生通入CO2+CO32-+H2O?2HCO3-,溶液的碱性减弱;
C.水解反应为吸热反应;
D.加入NaOH固体,c(OH-)增大,水解平衡逆向移动.
解答 解:A.$\frac{c(HC{O}_{3}^{-}C)•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$是该反应的水解平衡常数,水解平衡常数只与温度有关,则稀释溶液,水解平衡常数不变,故A正确;
B.通入CO2,发生通入CO2+CO32-+H2O?2HCO3-,溶液的碱性减弱,则溶液pH减小,故B错误;
C.水解反应为吸热反应,则升高温度,平衡常数增大,故C错误;
D.加入NaOH固体,c(OH-)增大,水解平衡逆向移动,可知$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小,故D错误;
故选A.
点评 本题考查水解平衡的移动,为高频考点,把握温度、浓度对水解平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意水解平衡常数只与温度有关,题目难度不大.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:解答题
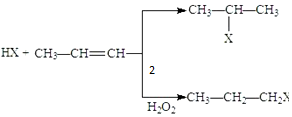 (X为卤素原子)
(X为卤素原子)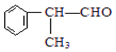 的物质,该物质是一种香料.
的物质,该物质是一种香料. $→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$
$→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$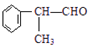
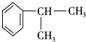 .
.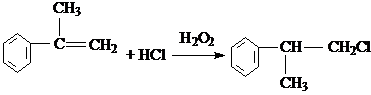 、2
、2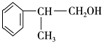 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.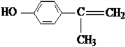 、
、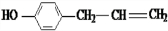 、
、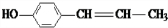 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 463kJ•mol-1 | B. | 926kJ•mol-1 | C. | 1852kJ•mol-1 | D. | 920kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 | |
| B. | 其他条件均相同,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长 | |
| C. | 原电池工作时,正极表面一定有气泡产生 | |
| D. | 钢铁水闸可用牺牲阴极或外加电流的阳极保护法防止其腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCHO与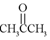 | B. | HOCH2CH3与CH3COOH | ||
| C. | HCOOH与C5H11COOH | D. | C2H4与C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
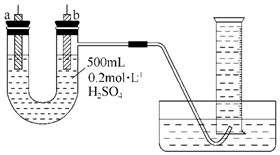 给你提供纯锌、纯铜片和500mL 0.2mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.
给你提供纯锌、纯铜片和500mL 0.2mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:NH3>H2O>H2S | |
| B. | 酸性:H2SO4>HClO4>H3PO3 | |
| C. | 结合质子的能力:CO32->ClO->CH3COO- | |
| D. | 气态氢化物的热稳定性:H2O>HF>NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com