
NA代表阿伏加德罗常数的数值。下列说法不正确的是
A.0.05 mol液态KHSO4中含有0.05 NA个阳离子
B.氢氧燃料电池正极消耗22.4 L气体时,电路中通过电子的数目为4 NA
C.常温下,100 mL 1 mol•L-l盐酸与4.6 g钠反应生成H2分子数目为0.1NA
D.在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数目为NA
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源:2017届江苏省高三上期初考试化学试卷(解析版) 题型:选择题
在探究SO2水溶液成分和性质的实验中,下列根据实验现象得出的结论正确的是
A. 向SO2水溶液中加入少量NaHCO3粉末,有气泡产生,说明SO2水溶液呈酸性
B. 向SO2水溶液中滴加Ba(NO3)2溶液,有白色沉淀产生,说明SO2水溶液中含有SO42-
C. 将SO2水溶液中通入H2S气体,有淡黄色沉淀产生,说明SO2水溶液具有氧化性
D. 向KMnO4溶液中滴加SO2水溶液,溶液颜色褪去,说明SO2水溶液具有漂白性
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三小二调考化学试卷(解析版) 题型:选择题
某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( )
A.Na+、SO42-、 、ClO- B.K+、Na+、HCO3-、NO3-
、ClO- B.K+、Na+、HCO3-、NO3-
C.H+、Mg2+、SO42-、NO3- D.Ag+、K+、NO3-、Na+
查看答案和解析>>
科目:高中化学 来源:2017届河北省等五校高三上学期第一次模拟化学试卷(解析版) 题型:选择题
一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,
2SO2+O2 2SO3,其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
2SO3,其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
甲 | 乙 | 丙 | 丁 | ||
密闭容器体积/L | 2 | 2 | 2 | 1 | |
起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 |
|
|
| |
A.甲中反应的平衡常数小于乙
B.该温度下,该反应的平衡常数K为400
C.SO2的平衡转化率: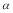 1>
1>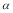 2 =
2 = 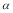 3
3
D.容器中SO3的物质的量浓度:丙=丁<甲
查看答案和解析>>
科目:高中化学 来源:2017届河北省等五校高三上学期第一次模拟化学试卷(解析版) 题型:选择题
下列有关实验装置进行的相应实验,能达到实验目的的是
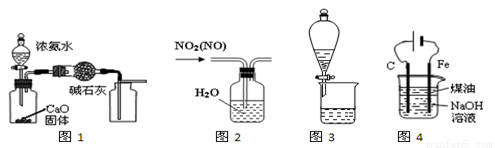
A.用图1装置制取并收集干燥的NH3
B.用图2所示装置可除去NO2中的NO
C.用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置制备Fe(OH)2并能较长时间观察其颜色
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上学期开学考试化学试卷(解析版) 题型:填空题
铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为_____________。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如右图所示。
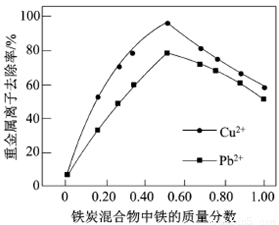
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________。
(3)纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为 。
②纳米铁粉与水中NO3-反应的离子方程式为 4Fe+ NO3-+10H+=4Fe2++NH4++3H2O,研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是 。
③相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见右图),产生该差异的可能原因是 。

查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上学期开学考试化学试卷(解析版) 题型:选择题
下列有关实验操作的叙述错误的是
A. 过滤操作中,漏斗的尖端应接触烧杯内壁。
B. 从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁。
C. 滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁。
D. 向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
一定温度下,反应N2(g)+O2(g)===2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是( )
A.缩小体积使压强增大 B.恒容,充入N2
C.恒容,充入He D.恒压,充入He
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上学期第一次月考化学试卷(解析版) 题型:计算题
把1mol X和1mol Y混合于2 L的密闭容器中,发生如下反应 2X(g)+Y(g) =nZ(g)
+2W(g),2min末X的物质的量为0.2mol,以Z的浓度表示的反应速率为0.1mol/(L·min)
请回答:
(1)前2min以X的浓度表示的平均反应速率
(2)n值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com