
【题目】弱电解质的电离平衡、盐类的水解平衡均属于溶液中的离子平衡。根据要求回答问題。
(1)常温下0.1mol·L-1的HA溶液中pH=3,则HA是______(填“强电解质”或“弱电解质”),其电离方程式____________________________________。
(2)已知:常温下0.1mol·L-1 BOH溶液pH=13,将V1L0.1mol·L-1HA溶液和V2L 0.1 mol·L-1BOH溶液混合,回答下列问题:
①当V1:V2=1:1时,溶液呈____性,请用离子方程式解释原因________________。
②当混合溶液pH=7时,溶液中离子浓度大小关系是_____________________。
【答案】弱电解质 HA![]() H++A- 碱 A-+H2O
H++A- 碱 A-+H2O![]() HA+OH- c(B+) = c(A-) > c(OH-) = c(H+)
HA+OH- c(B+) = c(A-) > c(OH-) = c(H+)
【解析】
(1)常温下0.1molL-1的HA溶液中pH=3,c(H+)=0.001mol/L,据此分析解答;
(2)常温下0.1molL-1BOH溶液pH=13,c(OH-)=0.1molL-1,说明BOH完全电离,属于强碱,结合盐类水解的规律和电荷守恒分析解答。
(1)常温下0.1molL-1的HA溶液中pH=3,c(H+)=0.001mol/L,说明HA不完全电离,属于弱电解质,其电离方程式为HAH++A-,故答案为:弱电解质;HAH++A-;
(2)①常温下0.1molL-1BOH溶液pH=13,c(OH-)=0.1molL-1,BOH完全电离,属于强碱,V1∶V2=1∶1时,HA和BOH恰好完全反应生成BA,BA为强碱弱酸盐,存在水解反应A-+H2OHA+OH-,溶液显碱性,故答案为:碱;A-+H2OHA+OH-;
②在反应后的混合溶液中存在电荷守恒c(B+)+c(H+)=c(A-)+c(OH-),当pH=7时c(OH-)=c(H+),故存在关系式c(B+)=c(A-)>c(OH-)=c(H+),故答案为:c(B+)=c(A-)>c(OH-)=c(H+)。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】实验室利用下列反应装置模拟侯氏制碱法制备NaHCO3,反应原理为:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,下列说法错误的是( )
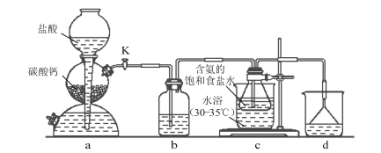
A.通过活塞K可控制CO2的流速
B.装置b、d依次盛装饱和Na2CO3溶液、稀硫酸
C.装置c中含氨的饱和食盐水提高了CO2吸收效率
D.反应后将装置c中的锥形瓶浸入冷水充分冷却,过滤得到NaHCO3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合元素周期律,结合下列事实推测不合理的是()
事实 | 推测 | |
A | IVA族 | 同族 |
B | HI在230℃时分解,HCl在1500℃时分解 | HF分解温度大于1500℃ |
C | H3PO4是中强酸,H2SO4是强酸 | HClO4是强酸 |
D | Na、Al通常用电解法冶炼 | Mg可用电解法冶炼 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰。海水冻结时,部分来不及流走的盐分以卤汁的形式被包围在冰晶之间,形成“盐泡”![]() 假设盐分以一个NaCl计
假设盐分以一个NaCl计![]() ,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )
,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )

A.海冰内层“盐泡”越多,密度越小
B.海冰冰龄越长,内层的“盐泡”越多
C.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
D.海冰内层NaCl的浓度约为![]() 设冰的密度为
设冰的密度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向NaX溶液和YCl溶液中加入盐酸和氢氧化钠溶液,混合溶液的pH与离子浓度变化关系如图所示,下列说法不正确的是

A.L1表示![]() 与pH的变化关系
与pH的变化关系
B.Kb(YOH)=10-10.5
C.a点时两溶液中水的电离程度不相同
D.0.1mol·L-1的YX溶液中离子浓度关系为:c(Y+)>c(X-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)为第五周期ⅡA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下:
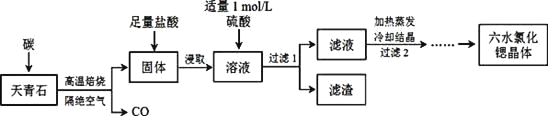
已知:① 经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质;
② SrSO4、BaSO4的溶度积常数分别为3.3×10-7、1.1×10-10;
③ SrCl2·6H2O的摩尔质量为:267 g/mol。
(1)天青石焙烧前先研磨粉碎,其目的是___________________。
(2)隔绝空气高温焙烧,若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:_____________________________________________。
(3)为了得到较纯的六水氯化锶晶体,过滤2后还需进行的两步操作是_______________。
(4)加入硫酸的目的是______________________。为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________mol/L(注:此时滤液中Ba2+浓度为1×10-5mol/L)。
(5)产品纯度检测:称取1.000g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2mol的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应的离子),待Cl―完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_________________________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为______(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH(OH)CH2CH![]() CH3CH=CHCH3+H2O,下列有关说法正确的是
CH3CH=CHCH3+H2O,下列有关说法正确的是
A.CH3CH=CHCH3分子中所有碳原子不可能处于同一平面
B.CH3CH=CHCH3和HBr加成产物的同分异构体有4种(不考虑立体异构)
C.CH3CH(OH)CH2CH3与乙二醇、丙三醇互为同系物
D.CH3CH(OH)CH2CH3、CH3CH=CHCH3均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计SO2实验方案,做以下化学实验。
Ⅰ.实验方案一
(1)将SO2通入水中形成“SO2-饱和H2SO3溶液”体系,此体系中存在多个含硫元素的平衡,写出其中1个平衡方程式:________________________________________。
(2)已知:葡萄酒中有少量SO2可以做抗氧化剂[我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25 g·L-1]。
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如图1的实验:
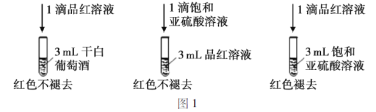
实验结论:干白葡萄酒不能使品红溶液褪色,原因为:_____________。
Ⅱ.实验方案二
如图2是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
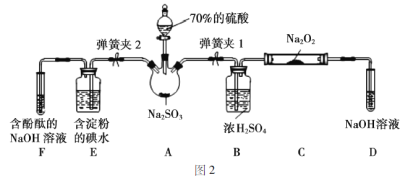
(1)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的方法是_________________________。
(2)装置D中盛放NaOH溶液的作用是______________________。
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,能说明I-还原性弱于SO2的现象为_____________;发生反应的离子方程式是______________。
Ⅲ.实验方案三
用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入图3装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能。M极发生的电极反应式为_______。
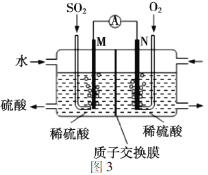
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构![]() ,有机物A的键线式结构为
,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A. 用系统命名法命名有机物A,名称为2,2,3﹣三甲基戊烷
B. 有机物A的一氯取代物只有4种
C. 有机物A的分子式为C8H18
D. B的结构可能有3种,其中一种名称为3,4,4﹣三甲基﹣2﹣戊烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com