
【题目】化合物W是合成一种抗心律失常药物的中间物质,一种合成该物质的路线如下:
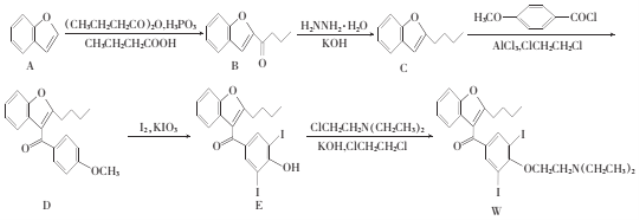
(1)ClCH2CH2C1的名称是____________。
(2)E中不含氧的官能团的名称为____________。
(3)C的分子式为__________,B→C的反应类型是____________。
(4)筛选C→D的最优反应条件(各组别条件得到的D的产率不同)如下表所示:
组别 | 加料温度 | 反应溶剂 | AlCl3的用量(摩尔当量) |
① | -30~0℃ |
| 1 eq |
② | -20~-10℃ |
| 1 eq |
③ | -20~-10℃ | ClCH2CH2Cl | 1 eq |
上述实验筛选了________和________对物质D产率的影响。此外还可以进一步探究___________对物质D产率的影响。
(5)M为A的同分异构体,写出满足下列条件的M的结构简式:__________________。
①除苯环外不含其他环;②有四种不同化学环境的氢,个数比为1:1:2:2;③1 mol M只能与1mol NaOH反应。
(6)结合上述合成路线,写出以![]() 、CH3I和SOCl2为基本原料合成
、CH3I和SOCl2为基本原料合成![]() 的路线图。(其他所需无机试剂及溶剂任选)
的路线图。(其他所需无机试剂及溶剂任选)
已知,RCOOH![]() RCOCl。
RCOCl。
____________________________________________________________________________________________。
【答案】1,2二氯乙烷 碘原子、碳碳双键 C12H14O 还原反应 加料温度 反应溶剂 氯化铝的用量 ![]()
![]()
![]()
![]()
![]()

![]()
![]()
【解析】
A发生取代反应生成B,B发生还原反应生成C,C发生取代反应生成D,D发生取代反应生成E,E发生取代反应生成W;
(1)该分子中含有2个碳原子,氯原子位于1、2号碳原子上;
(2)E中含有的官能团是醚键、碳碳双键、羰基、碘原子、酚羟基;
(3)根据结构简式确定分子式;B分子去掉氧原子生成C;
(4)对比表中数据不同点确定实验筛选条件;还可以利用氯化铝量的不同探究氯化铝对D产率的影响;
(5)M为A的同分异构体,M符合下列条件:
①除苯环外不含其他环;
②有四种不同化学环境的氢,个数比为1:1:2:2;
③lmolM只能与1molNaOH反应,说明含有1个酚羟基;
根据其不饱和度知还存在1个碳碳三键;
(6)以![]() 、CH3I和SOCl2为基本原料合成
、CH3I和SOCl2为基本原料合成![]() ,
,![]() 可由
可由 和SOCl2发生取代反应得到,
和SOCl2发生取代反应得到, 可由
可由![]() 发生氧化反应得到,
发生氧化反应得到,![]() 可由
可由![]() 和CH3I发生取代反应得到。
和CH3I发生取代反应得到。
A发生取代反应生成B,B发生还原反应生成C,C发生取代反应生成D,D发生取代反应生成E,E发生取代反应生成W;
(1)该分子中含有2个碳原子,氯原子位于1、2号碳原子上,所以其名称是1,2二氯乙烷;
(2)E中含有的官能团是醚键、碳碳双键、羰基、碘原子、酚羟基,所以不含氧官能团为碘原子和碳碳双键;
(3)根据结构简式确定分子式为C12H14O;B分子去掉氧原子生成C,该反应为还原反应;
(4)对比表中数据不同点确定实验筛选条件是加料温度和反应溶剂;还可以利用氯化铝量的不同探究氯化铝对D产率的影响;
(5)M为A的同分异构体,M符合下列条件:
①除苯环外不含其他环;
②有四种不同化学环境的氢,个数比为1:1:2:2;
③lmolM只能与1molNaOH反应,说明含有1个酚羟基;
根据其不饱和度知还存在1个碳碳三键,
则符合条件的结构简式为:![]() ;
;
(6)以![]() 、CH3I和SOCl2为基本原料合成
、CH3I和SOCl2为基本原料合成![]() ,
,![]() 可由
可由 和SOCl2发生取代反应得到,
和SOCl2发生取代反应得到, 可由
可由![]() 发生氧化反应得到,
发生氧化反应得到,![]() 可由
可由![]() 和CH3I发生取代反应得到,其合成路线为:
和CH3I发生取代反应得到,其合成路线为:![]()
![]()
![]()
![]()

![]()
![]() 。
。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
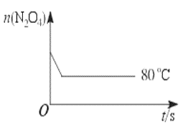
【题目】在80 ℃时,将0.40 mol的N2O4气体充入2 L真空的固定容积的密闭容器中,发生反应:N2O4 ![]() 2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) /mol | 0.40 | 0.28 | 0.20 | 0.14 | 0.10 | 0.10 |
n(NO2) /mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20~40 s内用N2O4表示的平均反应速率为__________。
(2)40s时,NO2的的浓度b=_________mol/L,反应最迟到________s到达平衡状态
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有___________(填序号)。
A. 增大N2O4的起始浓度 B. 向混合气体中通入NO2
C. 使用高效催化剂 D. 升高温度
(5)能说明该反应达到平衡状态的标志是_________(填序号)
A. 2 v(N2O4 ) =v(NO2 ) B. 容器内压强保持不变
C. 容器内密度保持不变 D. NO2的体积分数保持不变
(6)如图是80 ℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60 ℃时N2O4物质的量的变化曲线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如右图所示,下列说法正确的是
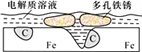
A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. 每生成1mol铁锈(Fe2O3·xH2O)理论上消耗标准状况下的O233.6L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员研制出透氧膜,它允许e-和O2-同时通过,可实现水连续分解制备氢气,工作时CO、H2O分别在透氧膜的两侧反应。工作原理如图所示,下列说法正确的是

A.CO在a侧上反应
B.b侧的反应式:H2O+2e- = H2↑+ O2-
C.该透氧膜可实现太阳能向氢能的转化
D.当有2mol电子通过透氧膜时,就会消耗22.4L CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】15.3 g Mg-Al合金(无其他成分),加入到500 mL稀硝酸中,恰好完全反应后,共收集到标准状况下的NO气体11.2 L,向所得溶液中加入4 mol/L NaOH溶液400 mL,得到白色沉淀。下列叙述中正确的是
A.合金中,m(Mg):m(Al)=1:1
B.原稀硝酸的物质的量浓度与NaOH溶液相同
C.白色沉淀的成分为Mg(OH)2
D.过滤后,向白色沉淀中加入原稀硝酸250 mL,可将沉淀全部溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究KI与FeCl3的反应为可逆反应,且有一定的限度,某化学小组进行了两组实验:
(1)请写出KI溶液与FeCl3溶液反应的离子反应方程式:______;
实验I:探究KI与FeCl3的反应为可逆反应
步骤1:设计如下图原电池装置,接通灵敏电流计,指针向左偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。

步骤2:当指针读数变零后,向甲中加入少量FeCl2固体,向乙中加入少量碘固体;
(2)若灵敏电流计出现_________(答现象),则证明该反应为可逆反应。实验结论:该反应为可逆反应。
(3)根据以上实验结论解释步骤1中“最后读数变为零”的原因_______;
(4)加入FeCl2和碘固体后,正极的电极反应式为______;
实验II:证明KI与FeCl3的反应有一定限度。
步骤3:取5 mL 0.1 mol/L的KI溶液于试管,滴加0.1 mol/L的FeCl3溶液2 mL,振荡;
步骤4:取少量反应后的溶液,向其中加入几滴淀粉溶液,充分振荡;
(5)观察到的现象是________;
步骤5:另取少量反应后的溶液,滴加0.1 mol/L的AgNO3溶液,振荡,产生黄色沉淀,则证明该反应有一定限度。
(6)但有同学认为步骤5现象不能证明得出的结论,原因是______,修正实验方案后得到结论:该反应有一定的限度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将SO2通入2L0.01mol·L-1的某一元碱MOH溶液中,溶液中水电离出的OH-的浓度(c)与通入的SO2的体积(V)关系如图所示(不考虑+4价的S被氧化),下列叙述不正确的是
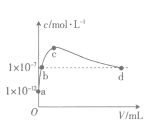
A.MOH为一元强碱
B.b点溶液中:c(H+)=1×10-7mol·L-1
C.c点溶液中:c(M+)=2[c(SO32-))+c(HSO3-)+c(H2SO3)]
D.d点溶液中:c(M+)=2c(SO32-)+c(HSO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物是生命产生的物质基础,其种类繁多。下列各组物质:①![]() 与
与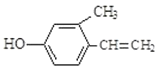 ②CH3CH2CH2CHO与CH3COCH2CH3;③淀粉和纤维素;④正戊烷和2-甲基丁烷;⑤
②CH3CH2CH2CHO与CH3COCH2CH3;③淀粉和纤维素;④正戊烷和2-甲基丁烷;⑤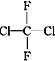 和
和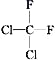 ;⑥
;⑥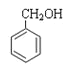 和
和![]() ;⑦2-甲基-1,3-丁二烯和1,3-丁二烯
;⑦2-甲基-1,3-丁二烯和1,3-丁二烯
(1)互为同系物的是_________________;(填序号,下同);互为同分异构体的是____________;
(2)物质![]() 的含氧官能团名称为_______________;
的含氧官能团名称为_______________;
(3)某单烯烃与足量氢气反应后能生成2-甲基丁烷,已知该烯烃分子中含有 3 个甲基,该烯烃的系统命名为______________;该烯烃在催化剂作用下,发生加聚反应产生高分子物质的化学方程式为_____________;
(4)某烃为正戊烷的同系物,其相对分子质量为114,其一氯代物只有一种,该烃的系统命名为_________。
(5)已知烯烃能够被臭氧氧化,其过程为:![]() ,若将②中两化合物看作是某单烯烃被臭氧氧化生成的,则该单烯烃的结构简式为_________________________。
,若将②中两化合物看作是某单烯烃被臭氧氧化生成的,则该单烯烃的结构简式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项表述与示意图一致的是:
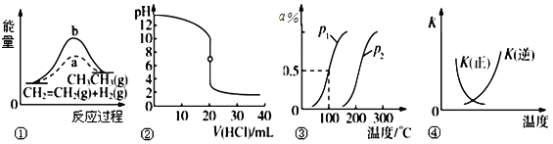
A.图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g) → CH3CH3(g)ΔH<0;使用和未使用催化剂时,反应过程中的能量变化
B.图②表示25 ℃时,用0.01 mol·L-1盐酸滴定一定体积的0.01 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
C.图③表示CH4(g)+H2O(g) ![]() CO(g)+3H2(g)ΔH,反应CH4的转化率与温度、压强的关系,且p1>p2,ΔH<0
CO(g)+3H2(g)ΔH,反应CH4的转化率与温度、压强的关系,且p1>p2,ΔH<0
D.图④ 中曲线表示反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH <0;正、逆反应的平衡常数K随温度的变化
2SO3(g) ΔH <0;正、逆反应的平衡常数K随温度的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com