
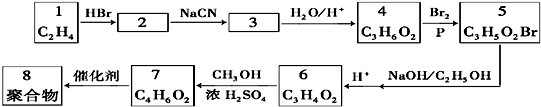

分析 乙烯与HBr发生加成反应生成2为CH3CH2Br,结合信息可知,CH3CH2Br与NaCN发生取代反应生成3为CH3CH2CN,CH3CH2CN水解得到4为CH3CH2COOH,CH3CH2COOH在Br2/P条件下发生取代反应生成5为CH3CHBrCOOH,CH3CHBrCOOH在氢氧化钠醇溶液条件下发生消去反应,再酸化得到6为CH2=CHCOOH,CH2=CHCOOH与甲醇发生酯化反应生成7为CH2=CHCOOCH3,CH2=CHCOOCH3发生加聚反应生成聚合物8为 ,据此解答.
,据此解答.
解答 解:乙烯与HBr发生加成反应生成2为CH3CH2Br,结合信息可知,CH3CH2Br与NaCN发生取代反应生成3为CH3CH2CN,CH3CH2CN水解得到4为CH3CH2COOH,CH3CH2COOH在Br2/P条件下发生取代反应生成5为CH3CHBrCOOH,CH3CHBrCOOH在氢氧化钠醇溶液条件下发生消去反应,再酸化得到6为CH2=CHCOOH,CH2=CHCOOH与甲醇发生酯化反应生成7为CH2=CHCOOCH3,CH2=CHCOOCH3发生加聚反应生成聚合物8为 ,
,
(1)A.化合物3为CH3CH2CN,不含羧基,故不选;
B.化合物4为CH3CH2COOH,含有羧基,故选;
C.化合物6为CH2=CHCOOH,含有羧基,故选;
D.化合物7 CH2=CHCOOCH3,不含羧基,故不选,
故选:BC;
(2)化合物4→8的合成路线中,依次发生的取代反应、消去反应、酯化反应(属于取代反应)、加聚反应,未涉及还原反应,
故选:D;
(3)CH3COOC2H5 属于酯,C6H5COOH属于芳香酸,CH3CH2CH2COOH、CH2=CH-COOH,属于酸,CH3CH2CH2COOH与D是同系物,CH2=CH-COOH与D不是同系物,
故选:C;
(4)化合物4为CH3CH2COOH,属于酯类的所有同分异构体有:HCOOCH2CH3、CH3COOCH3,
故答案为:HCOOCH2CH3、CH3COOCH3;
(5)6为CH2=CHCOOH,CH2=CHCOOH与甲醇发生酯化反应生成7为CH2=CHCOOCH3,该反应方程式为CH2=CHCOOH+CH3OH$?_{△}^{浓硫酸}$CH2=CHCOOCH3+H2O,故答案为:CH2=CHCOOH+CH3OH$?_{△}^{浓硫酸}$CH2=CHCOOCH3+H2O.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识迁移能力,根据流程图中某些物质结构简式或分子式结合题给信息进行推断,正确推断各物质结构简式是解本题关键,题目难度不大.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1 mol碳酸钠晶体中含有CO32-的个数为0.1NA | |
| B. | 标准状况下22.4 L H2O所含分子数为NA | |
| C. | 1 L 0.5 mol•L-1 CH3COOH溶液中,CH3COO-的个数为0.5NA | |
| D. | 在NO、NO2的混合气体22.4 L中,含有的氮原子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
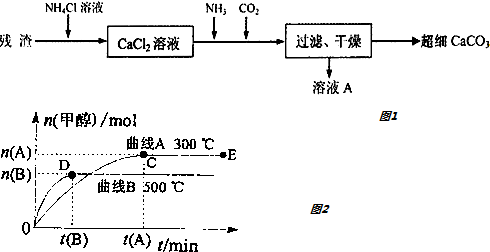
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | HCl溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 10.00 | 0.50 | 20.51 |
| 第二次 | 10.00 | 4.00 | 24.00 |
| 第三次 | 10.00 | 5.11 | 25.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
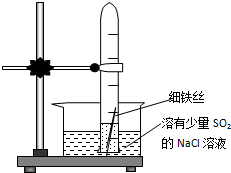 有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.过一会儿:
有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.过一会儿:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨工业对工、农业生产和国防都有重要意义.
合成氨工业对工、农业生产和国防都有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com