
【题目】下列关于现有元素周期表的叙述正确的是( )
A. 共有 6 个周期,16 个族 B. 共有 7 个周期,18 个族
C. 共有 6 个周期,18 个族 D. 共有 7 个周期,16 个族
科目:高中化学 来源: 题型:
【题目】已知 2A(g)+B(g) 2C(g) ΔH= -a kJ·mol-1(a>0) ,在一个有催化剂、固定容积的容器中加入 2 mol A 和 1 mol B,在 500 ℃时充分反应达到平衡后C 的浓度为 x mol·L-1,放出热量bkJ。请回答下列问题:
(1) a_____b(填“>”、“=”或“ <”)。
(2)下表为不同温度下反应的平衡常数。由此可推知,表中 T1_____ T2(填“>”、“< ”或“ =”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.54×105 | 1.88×103 |
若在原来的容器中,只加入 2 mol C,500 ℃时充分反应达到平衡后,吸收热量 c kJ,则 C 的浓度_____x mol·L-1(填“>”、“=” 或“ <”),a、b、c 之间满足何种关系?_____(用代数式表示)
(3)在相同条件下要想得到 2a kJ 热量,加入各物质的物质的量可能是_____(填字母)。
A.4 mol A 和 2 mol B B.4 molA、2 mol B 和 2 mol C
C.4 mol A 和 4 mol B D.6 molA 和 4 mol B
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是_____(填字母)。
A.及时分离出C 气体 B.适当升高温度 C.增大 B 的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入 2 mol A 和 1 mol B,500 ℃时充分反应达到平衡后,放出热量 d kJ,则 d_____b(填“>”、“=” 或“ <”),理由是_____。
(6)在一定温度下,在一个容积不变的容器中通入 2 mol A 和 1 mol B 及适量固体催化剂,使反应达到平衡。保持同一反应温度,在相同容器中,将起始物质改为 4 mol A 和 2 mol B,则平衡时A 的转化率_____(填“不变”、“变大”、“变小”或“不能确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Prolitane是一种抗抑郁药物,以芳香烃A为原料的合成路线如下:

请回答以下问题:
(1)D的化学名称为______,H→Prolitane的反应类型为______。
(2)E的官能团名称分别为______和______。
(3)B的结构简式为______。
(4)F→G的化学方程式为______。
(5)C的同分异构体中能同时满足下列条件的共有______种(不含立体异构);
①属于芳香化合物 ②能发生银镜反应 ③能发生水解反应
其中核磁共振氢谱显示为4组峰,其峰面积比为3∶2∶2∶1,写出符合要求的该同分异构体的结构简式______。
(6)参照Prolitane的合成路线,设计一条由苯和乙醇为原料制备苯甲酸乙酯的合成路线_____________(其他无机试剂和溶剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 L 1 mol·L-1的氨水中( )
A.含有1 mol NH3分子
B.含NH3和NH4+的物质的量之和为1 mol
C.含NH3·H2O、NH4+的物质的量之和为1 mol
D.含NH3、NH3·H2O、NH4+的物质的量之和为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是

A. a和b都属于芳香族化合物 B. b和c都能与新制Cu(OH)2溶液反应
C. a、b和c均能使酸性KMnO4溶液褪色 D. b和c互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以生产硼砂晶体的废渣为原料制取七水合硫酸镁的工艺流程如下:

资料:(1)生产硼砂晶体的废渣主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO:MnO、SiO2等杂质。
(2)滤渣C的成分为CaSO4·2H2O
回答下列问题:
(1)“酸浸”实验中,镁的浸出率结果如下图所示。由图可知,当镁的浸出率为80%时,所采用的实验条件为___________;

(2)滤渣B中含有不溶于稀盐酸、但能溶于热的浓盐酸的黑色固体,写出生成该黑色固体的离子方程式______________________;
(3)流程中加入的物质A是______________________;
(4)从滤液C中得到MgSO4·7H2O步骤为______________________;
(5)硼砂也可用于工业上制取NaBH4,NaBH4被称为有机化学中的“万能还原剂”。
①写出NaBH4的电子式:___________;
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaHB4的有效氢含量为___________(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是

A. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)将减小
B. 一定温度下,反应“2HI(g)![]() H2(g)+I2(g) △H>0”能自发进行,则该反应△S>0
H2(g)+I2(g) △H>0”能自发进行,则该反应△S>0
C. 向滴有酚酞的Na2CO3溶液中滴加BaCl2溶液,红色逐渐褪去,说明BaCl2溶液显酸性
D. 上图电池放电时的正极反应式:2Li++Li2O2+2e—=2Li2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。请你结合下列有关图示和所学知识回答:
I.用CO2催化加氢可以制取乙烯:CO2(g)+3H2(g)![]() 1/2C2H4(g)+2H2O(g)。
1/2C2H4(g)+2H2O(g)。
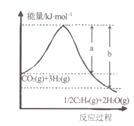
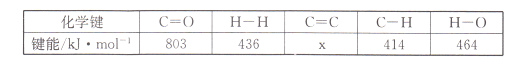
(l)若该反应体系的能量随反应过程变化关系如图所示,则该反应△H =___________(用含a、b的式子表示);又知:相关化学键的键能如下表所示,实验测得上述反应的△H =-152 kJ/mol,则表中的x= ___。
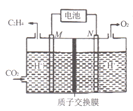
(2)以稀硫酸为电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如图所示。则M极上的电极反应式为____。
II.用CO2催化加氢还可以制取二甲醚:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H =-122.5kJ/mol,某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。
CH3OCH3(g)+3H2O(g)△H =-122.5kJ/mol,某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。
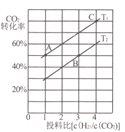
(3)图中T1、T2分别表示反应温度,判断T1、T2大小关系的依据是____;图中A、B、C三点对应的平衡常数分别为KA、KB、Kc,其三者大小的关系是____。
(4)T1温度下,将6molCO2和12molH2充入2L的密闭容器中,经过5min反应达到平衡,则0~5min内的平均反应速率υ(H2)=_______,平衡常数K=__(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com