
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.11.2 L N2所含分子数为0.5NA
B.常温下,16 g CH4中共用电子对的数目为4NA
C.一定温度下,1 mol FeCl3水解生成NA个Fe(OH)3胶体颗粒
D.在反应H2O2+Cl2=2HCl+O2中,每生成32 g氧气,转移4NA个电子
科目:高中化学 来源:2014年高考化学苏教版总复习 10-4 化学实验方案设计与评价练习卷(解析版) 题型:选择题
下列有关化学实验的叙述正确的是( )
A.为了增强高锰酸钾溶液的氧化能力,用稀盐酸将高锰酸钾溶液进行酸化
B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.用稀盐酸洗涤盛放过石灰水的试剂瓶
D.欲配制质量分数为10%的ZnSO4溶液,将10 g ZnSO4·7H2O溶解在90 g水中
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-4 氧化还原反应练习卷(解析版) 题型:选择题
被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)( )
A.NaBH4既是氧化剂又是还原剂
B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原
D.被氧化的元素与被还原的元素质量之比为1:1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-3 溶液的配制及分析练习卷(解析版) 题型:选择题
将质量分数为a%、物质的量浓度为c1 mol·L-1的稀H2SO4蒸发掉一定量的水,使其质量分数为2a%。此时溶液的物质的量浓度为c2 mol·L-1。则c1和c2的关系是( )
A.c1=2c2 B.c2<2c1
C.c2>2c1 D.c2=2c1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-2 物质的量、物质的聚集状态练习卷(解析版) 题型:填空题
在120℃、101 kPa条件下,由H2、CH4、CO组成的混合气体a mL,通入一定量(设为x mL)氧气使其完全燃烧。
(1)若a mL混合气体完全燃烧消耗相同条件下氧气的体积也为a mL,(即x=a),则原混合气体中CH4的体积分数是 ;
(2)若完全燃烧后生成CO2和H2O(g)的总体积在相同条件下为2a mL,则原混合气体中CH4的体积分数是 ,现要测定原混合气体中H2的体积分数,还必须知道相同条件下的其他数据,可以是 (填选项字母);
A.2a mL混合气体的密度
B.生成CO2气体的总体积
C.生成H2O(g)的总质量
(3)若原混合气体完全燃烧时,生成的气体中只有CO2和H2O(g),则x的取值范围是 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-2 物质的量、物质的聚集状态练习卷(解析版) 题型:选择题
现有甲、乙两种氧化物,所含R元素的质量分数分别为0.50和0.40,若已知甲为三原子分子,则乙的化学式为( )
A.RO2 B.RO3 C.R2O3 D.R2O5
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-1 物质的分类、转化及分散系练习卷(解析版) 题型:填空题
取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式: ,反应后得到的溶液呈 色。用此溶液分别做如下实验:
(1)取少量溶液置于试管中,滴入几滴NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为 ,此反应属于 。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈 色,即制得Fe(OH)3胶体。
(3)取另一只小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到 烧杯中的液体产生丁达尔效应。这个实验可以用来区别 。
(4)取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀HI溶液,边滴加边振荡,会出现一系列变化。
①先出现红褐色沉淀,随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式: 。
②最后溶液颜色加深,原因是 。(用离子方程式表示)。
③用稀盐酸代替稀HI溶液,能出现上述哪些相同的变化现象 (写序号)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习3-3铁、铜的获取及应用练习卷(解析版) 题型:填空题
有关FeSO4的转化关系如图所示(部分物质已略去)。

已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。
②Y是红棕色的化合物。
(1)气体X的成分是(填化学式) 。
(2)反应Ⅰ的反应类型属于(填序号) 。
a.分解反应 b.复分解反应
c.置换反应 d.化合反应
e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是 。
(4)若经反应Ⅰ得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol·L-1 NaOH溶液完全吸收,则反应Ⅳ中生成FeSO4的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-2电解质 离子反应练习卷(解析版) 题型:填空题
某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计除去污水中的金属离子,并回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
【药品】NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
【实验方案】
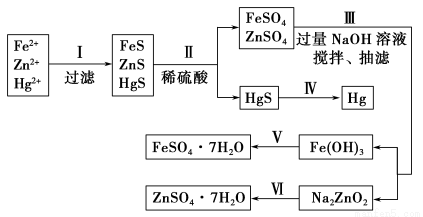
【问题探究】
(1)步骤Ⅱ所发生反应的离子方程式为 。
(2)步骤Ⅲ中抽滤的目的是 ,该步骤产生Fe(OH)3的反应的离子方程式为 。
(3)步骤Ⅵ中得到硫酸锌溶液的离子方程式为 。
(4)欲实现步骤Ⅴ,需加入的试剂有 、 ,所涉及的主要操作依次为 。
(5)步骤Ⅳ常用的方法是 ,该步骤是否对环境有影响? (填“是”或“否”),如有影响,请你设计一个绿色环保方案来实现步骤Ⅳ的反应: 。
(6)该研究小组的同学在强碱溶液中,用次氯酸钠与Fe(OH)3反应获得了高效净水剂Na2FeO4,该反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com