
【题目】某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,发生反应:A(g)+B(g) ![]() C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
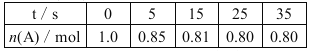
A.反应在前5 s的平均速率v(A)=0.03 mol·L-1·s-1
B.达到平衡时,B的转化率为80%
C.相同温度下,若起始时向容器中充入2.0 mol C,则达到平衡时C的浓度小于0.2 mol·L-1
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆)
【答案】D
【解析】
试题分析:A的物质的量达到0.70mol反应达到平衡状态,则
A(g)+B(g)![]() C(g)
C(g)
起始量(mol) 1.0 1.0 0
变化量(mol) 0.20 0.20 0.20
平衡量(mol) 0.80 0.80 0.20 可知:K=(0.20/2)÷[0.80/2×0.8/2]=5/8
A.反应在前5s的平均速率v(A)=(1.0mol-0.85mol)/2L÷5s=0.015mol/(L·s),故A错误;B.达到平衡时B的转化率为0.20mol/1mol×100%=20%,故B错误;C.相同温度下,若起始时向容器中充入2.0 mol C,等效为起始加入2.0mol A和2.0mol B,与原平衡相比,压强增大,平衡向正反应方向移动,平衡时的AB转化率较原平衡高,故平衡时AB的物质的量小于1.6mol,C的物质的量大于0.4mol,平衡浓度大于0.4mol/2L=0.2 mol·L-1,故C错误;D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,此时Qc=(1.0/2)÷[0.20/2×0.2/2]=50>5/8,此时反应向逆方向进行,即达到平衡前v(正)<v(逆),故D正确,答案为D。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】任一定温度下的定容容器中,当下列物理量不再发生变化时,能说明I2(g)+H2(g) ![]() 2HI(g)能说明达到平衡状态的有几个:①混合气体的压强②混合气体的密度③混合气体的总物质的量④混合气体的平均相对分子质量⑤混合气体的颜色⑥各反应物或生成物的浓度之比等于化学计量数之比⑦某种气体的百分含量。
2HI(g)能说明达到平衡状态的有几个:①混合气体的压强②混合气体的密度③混合气体的总物质的量④混合气体的平均相对分子质量⑤混合气体的颜色⑥各反应物或生成物的浓度之比等于化学计量数之比⑦某种气体的百分含量。
A. 2个 B. 3个 C. 4个 D. 5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物品或设备:①水泥路;②门窗玻璃;③水晶镜片;④石英钟表;⑤玛瑙手镯;⑥硅太阳能电池;⑦光导纤维;⑧计算机芯片。所用材料含有SiO2的是( )。
A.①②③④⑤⑦
B.①②⑦⑧
C.⑥⑧
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 写出镍原子的电子排布式_____________。
(2) 丙酮(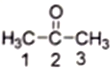 )分子中2号碳原子的杂化方式为__________;与CS2互为等电子体的阴离子是__________(写一种)。
)分子中2号碳原子的杂化方式为__________;与CS2互为等电子体的阴离子是__________(写一种)。
(3)含0.1mol[Cr(H2O)Cl]Cl2·H2O的水溶液与足量硝酸银溶液反应生成_______molAgCl沉淀。H2O分子的键角比H2S分子的键角大,原因是_______ 。
(4) 由铜与氯形成的一种化合物的晶胞结构如图所示(黑点代表铜原子)。

①该晶体的化学式为_______。
②将晶胞内的4个黑点相互连接所形成的立体构型是_______。
③晶体中与一个氯原子距离最近的氯原子有_______个。
④已知该晶体的密度为ρg.cm-3,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为_______pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.不可将水直接倒入浓硫酸中进行稀释
B.浓硫酸可用于干燥O2、CO2
C.硝酸与铁反应可产生H2
D.浓硫酸对皮肤或衣服有很强的腐蚀性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: Mg能在NO2中燃烧,可能产物为Mg3N2、MgO和N2。Mg3N2容易与水反应。
(1) 某实验探究小组探究Mg与NO2反应的固体产物成分,对固体产物提出三种假设:
I.假设为: 固体产物为MgO;II.假设为:________;III.假设为: ________。
(2) 该小组通过如下实验装置来验证Mg在NO2中燃烧反应产物(夹持装置省略,部分仪器可重复使用
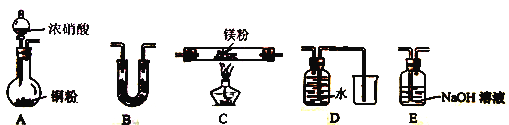
①实验装置连接的顺序为____________(填字母序号);
②装置B中盛装的试剂可以是_______ (填字母)
a.浓硫酸 b.碱石灰 c.无水CaCl2 d.五氧化二磷
③确定产物中有N2生成的实验现象为_____________________。
(3)设计实验证明: 产物中存在Mg3N2: ____________________。
(4)己知装置C中初始加入Mg粉质量为13.2g,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为21.0g,产生N2的体积为1120mL(标准状况)。写出玻璃管中发生反应的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定,请回答下列问题:
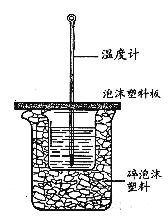
(1)大小烧杯之间填满碎泡沫塑料的作用是___________,做1次完整的中和热测定实验,温度计需使用________次,从实验装置上看,图中缺少的一种玻璃仪器是______________ 。
(2)使用补全仪器后的装置进行实验,取50mL0.25mol/LH2SO4溶液与 50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的比热容c为 4.18J/ (g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H= ______ , H2SO4与NaOH反应的热化学方程式_______________ 。
(3)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量___________ (填“相等”、“不相等”),所求中和热___________(填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会_______。(填“偏大”、“偏小”、“不受影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学设计如下装置(图中药品均足量):
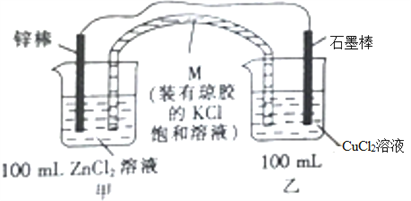
(1)M的名称是_________。
(2)烧杯乙中的现象是_____________________________。
(3)负极的电极反应式为____________________________________________,电池总反应的化学方程式为_____________。
(4)M的作用是向甲、乙两绕杯中提供K+或Cl-,以确保溶液呈电中性。当锌棒质量变化6.5g时,从M中进入装置乙内的离子是__________,其浓度为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com