
| A. | 网状结构的聚丙烯酸钠是高吸水性树脂,可用于制造“尿不湿” | |
| B. | 光导纤维应避免在强碱性环境中使用 | |
| C. | 利用超临界C02流体作为萃取溶剂符合绿色化学 | |
| D. | 船体镀锌或锡均可保护船体,镀层破损后将立即失去保护作用 |
分析 A.聚丙烯酸钠是一种高分子树脂吸水性很强;
B.二氧化硅能够与碱反应;
C.超临界流体CO2替代有机溶剂,替代一些对环境和健康带来危害的有机溶剂,可以减少对空气的污染;
D.原电池的负极是容易有被氧化的电极,易被腐蚀;
解答 解:A.聚丙烯酸钠是一种高分子树脂具有很强的吸水性,故A正确;
B.二氧化硅能够与碱反应,所以光导纤维应避免在强碱性环境中使用,故B正确;
C.超临界流体CO2替代有机溶剂,替代一些对环境和健康带来危害的有机溶剂,可以减少对空气的污染,故C正确;
D.锌活泼性强于铁,锡活泼性弱于铁,镀锌铁破损后仍然能够保护铁,镀锡铁破损后加速铁的腐蚀,故D错误;
故选:D.
点评 本题考查了物质的性质、金属的腐蚀与防护,熟悉相关物质的性质及原电池工作原理是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
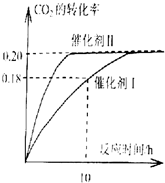 已知CO2可以生产绿色燃料甲醇,反应如下:
已知CO2可以生产绿色燃料甲醇,反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位物质的量的气体所占的体积就是气体摩尔体积 | |
| B. | 通常状况下的气体摩尔体积约为22.4 L | |
| C. | 标准状况下的气体摩尔体积约为22.4 L | |
| D. | 相同物质的量的气体摩尔体积也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
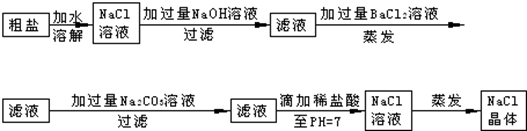
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com