
布洛芬(C13H18O2)具有抗炎、镇痛、解热作用,其合成路线如下:
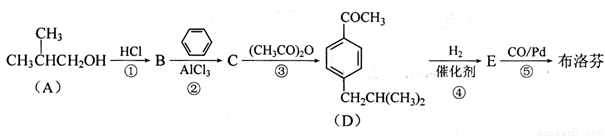
已知: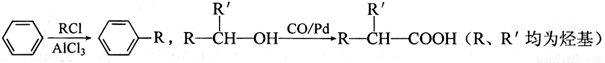
请回答以下问题:
(1)反应①〜⑤中,属于取代反应的有______ (填编号);
(2)E中官能团的名称为______;
(3)布洛芬的结构简式为______。
(4)写出反应③的化学方程式:____________。
(5)比布洛芬少5个碳原子的同系物X有多种同分异构体,写出同时满足下列条件的 所有
X的同分异构体结构简式:_________________;
a.属于芳香族酯类化合物 b.核磁共振氢谱呈现4种峰,且峰面积之比为3:2:2:1
写出其中一种能发生银镜反应的物质在NaOH溶液中水解的反应方程式:______。
科目:高中化学 来源:2016-2017学年江西省南昌市、洪都中学、麻丘中学、十七中、桑海中学高二3月联考化学试卷(解析版) 题型:选择题
常温下,下列有关离子浓度及pH大小的比较正确的是 ( )
A. NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序为③>②>①
B. 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是c(CH3COO)>c(Na+)>c(H+)>c(OH-)
C. pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13<pH<14
D. pH=13的Ba(OH)2溶液与pH=1的盐酸等体积混合,混合溶液的pH>7
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省枣庄市北校区高一下学期第一次月考化学试卷(解析版) 题型:选择题
甲、乙是元素周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A. x+2 B. x+4
C. x+8 D. x+18
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古赤峰市宁城县高三一模理科综合化学试卷(解析版) 题型:简答题
铁碳合金在现代建筑中占有十分重要的地位。
(1)基态Fe3+的M能层上电子排布式为_______,铁元素可形成多种配合物,如K3[Fe(CN)6]和Fe(CO)5,则这两种配合物所涉及的元素中,第一电离能由大到小的顺序为________,电负性最大的是_______。
(2)三聚氰胺(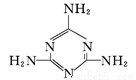 )中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
)中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
①三聚氰胺中,环上与环外的氮原子杂化轨道类型分别为_______。
②导致三聚氰胺与硝基苯熔点相差很大的根本原因是____________________。
(3)已知常温下草酸(HOOC—COOH)的电离平衡常数Ka1=5.6×10-2、Ka2=1.5×10-4,试从结构上解释Ka1、Ka2数值上的差异__________________。
(4)一定条件下,碳、氮两种元素可形成一种化合物,该化合物可作耐磨材料,其熔点________(填“高于”、“低于”或“无法判断”)金刚石的熔点。
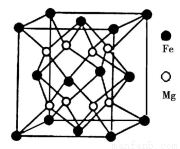
(5)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为________,若该晶胞的参数为dnm,则该合金的密度为____________(不必化简,用NA表示阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古赤峰市宁城县高三一模理科综合化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 下列叙述错误的是
下列叙述错误的是
A. 放电时正极附近溶液的碱性增强
B. 充电时锌极与外电源正极相连
C. 放电时每转移3 mol电子,正极有1mol K2FeO4被还原
D. 充电时阳极反应为:Fe(OH)3 - 3e- + 5OH- FeO42- + 4 H2O
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三2月模拟理科综合化学试卷(解析版) 题型:选择题
过碳酸钠(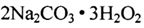 )在生产和生活领域应用广泛,其制备反应为:
)在生产和生活领域应用广泛,其制备反应为: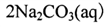
 。过碳酸钠具有Na2CO3和H2O2的双重性质, 在500C时分解为碳酸钠和过氧化氢。下列有关说法错误的是
。过碳酸钠具有Na2CO3和H2O2的双重性质, 在500C时分解为碳酸钠和过氧化氢。下列有关说法错误的是
A. 实验室制备过碳酸钠时可釆用冷水浴控制反应温度
B. 过碳酸钠水溶液呈碱性,可用作漂洗剂和消毒杀菌剂
C. 过碳酸钠应密封保存,放置于冷暗处
D. 过碳酸钠可使酸性高锰酸钾溶液褪色,并放出一种无色气体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:简答题
在100℃时,将0.40 mol二氧化氮气体充入一个1 L抽空的密闭容器中,发生反应:2NO2 N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为_____________。
(2)该反应的平衡常数K的数值为___________(精确到0.1)。
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是______mol·L?1。
(4)上述(3)达到平衡后N2O4的转化率为_______,混合气体的平均摩尔质量为____________。
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2 N2O4的平衡常数将________(填“增大”“减小”或“不变”)。
N2O4的平衡常数将________(填“增大”“减小”或“不变”)。
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将_____(填“向左移动”“向右移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二2月联考化学试卷(解析版) 题型:选择题
为了除去硫酸铜溶液中含有的Fe2+杂质,先加入合适的氧 化剂使Fe2+氧化为Fe3+,下列物质中最好选用
化剂使Fe2+氧化为Fe3+,下列物质中最好选用
A. Cl2水 B. H2O2溶液 C. KMnO4溶液 D. HNO3溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一下学期第一次月考化学试卷(解析版) 题型:选择题
短周期元素X、Y的原子序数相差7,下列有关判断错误的是
A. X和Y可能处于同一周期 B. X和Y可能处于相邻周期
C. X和Y可能处于同一主族 D. X和Y可能处于相邻主族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com