
分析 (1)则HCl气体的体积为VL,溶液的体积为VL,利用n=$\frac{V}{{V}_{m}}$、c=$\frac{n}{V(aq)}$来计算;
(2)NO2和O2按体积比4:1混合后充入一干燥烧瓶中,把烧瓶倒置于水中发生反应:4NO2+O2+2H2O=4HNO3,根据方程式计算;
(3)NO和O2按体积比4:3混合后充入一干燥烧瓶中,把烧瓶倒置于水中发生反应:4NO+3O2+2H2O=4HNO3,根据方程式计算;
解答 解:(1)则HCl气体的体积为VL,
标准状况下,n(HCl)=$\frac{V}{22.4}$mol,最终溶液的体积为VL,
则c=$\frac{\frac{V}{22.4}}{V}$V=$\frac{1}{22.4}$mol/L,故答案为:$\frac{1}{22.4}$;
(2)设混合气体中含有4VLNO2,1VLO2,则烧瓶的体积为5VL,
4NO2 +O2 +2H2O=4HNO3
$\frac{4V}{22.4}$mol $\frac{V}{22.4}$mol $\frac{4V}{22.4}$mol
c(HNO3)=$\frac{\frac{4V}{22.4}mol}{5VL}$=$\frac{1}{28}$mol/L,故答案为:$\frac{1}{28}$;
(3)设混合气体中含有4VLNO,3VLO2,则烧瓶的体积为7VL,4NO+3O2+2H2O=4HNO3,c(HNO3)=$\frac{\frac{4V}{22.4}mol}{7VL}$=$\frac{1}{39.2}$,故答案为:$\frac{1}{39.2}$.
点评 本题考查物质的量浓度的计算,明确试管容积、气体体积、溶液体积的关系是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 明矾投入水中的电离方程式为:KAI(SO4)2•12H2O=K++Al3++2SO42-+12H20,说明明矾是一种混合物 | |
| B. | 净水时Al3+发生水解生成的是Al(OH)3沉淀 | |
| C. | 明矾净水的原理是杀菌消毒 | |
| D. | 硫酸铁可以代替明矾进行净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
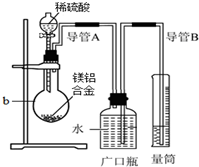 化学学习小组对某镁铝合金进行了如下实验研究,请你参与并完成对有关问题的解答.
化学学习小组对某镁铝合金进行了如下实验研究,请你参与并完成对有关问题的解答.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6 mol/(L•s) | B. | 0.08 mol/(L•s) | C. | 0.16 mol/(L•s) | D. | 0.8 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
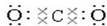 ,O=C=O.
,O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
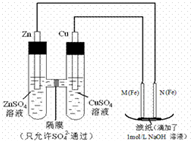 某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.
某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Na+<S2-<Cl-<K+ | B. | 还原性:I-<Br-<-Cl<F- | ||
| C. | 稳定性:SiH4<PH3<HCl<HBr | D. | 溶解性:BaO4<CaSO4<MgSO4. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com