
����Ŀ��CH4��H2��C�������ʵ���Դ���ʣ�����ȼ�յ��Ȼ�ѧ����ʽΪ�� ��CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=��890.3kJ/mol
��2H2��g��+O2��g���T2H2O��l����H=��571.6kJ/mol
��C��s��+O2��g���TCO2��g����H=��393.5kJ/mol
��1����д���һ�ּ���ϸ������������øʹ������O2���ò���������������ϸ��ʹ1mol��������CO2������Һ̬ˮ���ų����������������������=����890.3kJ��
��2��������CO2�����ںϳɺϳ�������Ҫ�ɷ���һ����̼����������CH4+CO2�T2CO+2H2 �� 1gCH4��ȫ��Ӧ���ͷ�15.46kJ���������� ��ͼ1���ܱ�ʾ�÷�Ӧ�����������仯����������ĸ����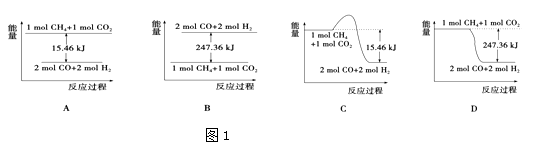
���������ʵ�����Ϊ1mol��CH4��CO2����ij�����ܱ������У���ϵ�ų�����������ʱ��ı仯��ͼ2��ʾ����CH4��ת����ԼΪ �� 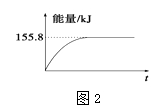
��3��C��s����H2��g������Ӧ������C��s��+2H2��g���TCH4��g���ķ�Ӧ����ֱ�Ӳ�������ͨ��������Ӧ�����C��s��+2H2��g���TCH4��g���ķ�Ӧ�ȡ�H= ��
��4��ͼ3�Ǽ���ȼ�ϵ��ԭ��ʾ��ͼ����ش��������⣺ 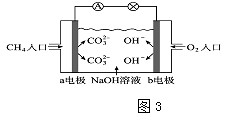
�ٵ�صĸ��������a����b�����缫�������ϵĵ缫��Ӧ�� ��
�ڵ�ع���һ��ʱ���������Һ��pH���������С�����䡱����
���𰸡�
��1��=
��2��D��63%
��3����74.8 kJ?mol��1
��4��a��O2+2H2O+4e��=4OH������С
���������⣺��1��CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=��890��.3kJmol��1 �� �õ�����ϸ��ʹ1mol��������CO2������Һ̬ˮ�ų�����������890��.3kJmol��1 �� ���Դ��ǣ�=����2���ټ�����CO2�����ںϳɺϳ�������Ҫ�ɷ���һ����̼����������CH4+CO2�T2CO+2H2 �� 1g CH4��ȫ��Ӧ���ͷ�15.46kJ������������1mol������ȫ��Ӧ�ų�������=15.46KJ��16=247.36KJ����Ӧ�ʱ��H=��247.36KJ/mol����ӦΪ���ȷ�Ӧ����Ӧ�����������������Ӧ���Ȼ�ѧ����ʽΪ��CH4��g��+CO2��g���T2CO��g��+2H2��g�� �� ��H=��247.36KJ/mol�����������仯��ͼ��ֻ��D���ϣ�
���Դ��ǣ�D�� �ڷ�Ӧ���Ȼ�ѧ����ʽΪ��CH4��g��+CO2��g���T2CO��g��+2H2��g�� �� ��H=��247.36KJ/mol��ͼ���֪��Ӧ�ﵽƽ��״̬�ų�����155.80KJ����Ӧ�ļ������ʵ���= ![]() =0.63mol������ת����Ϊ63%��
=0.63mol������ת����Ϊ63%��
���Դ��ǣ�63%����3����֪����CH4��g��+2O2��g��=CO2��g��+2H2O��l������H1=��890.3kJ/mol����2H2��g��+O2��g���T2H2O��l����H=��571.6kJmol��1��C��s��+O2��g��=CO2��g������H2=��393.5kJ/mol
��˹���ɼ��㣬��+�۩��ٵõ�����ӦC��ʯī��s��+2H2��g��=CH4��g����H=��74.8 kJmol��1 ��
���Դ��ǣ���74.8 kJmol��1����4�����ټ��Լ���ȼ�ϵ����ͨ������һ��aΪԭ��صĸ������ü�����ȼ�Ϸ���ʧ���ӵ�������Ӧ��ͨ��������һ��Ϊԭ��ص������������õ��ӵĻ�ԭ��Ӧ����O2+2H2O+4e��=4OH�� �� ���Դ��ǣ�a��O2+2H2O+4e��=4OH�������ڼ�����Һ�У�����ȼ�ϵ�ص��ܷ�ӦʽΪCH4+2O2+2OH��=CO32��+3H2O����ع���һ��ʱ����������������ӱ����ģ����Ե������Һ��pH���С��
���Դ��ǣ���С��
�����㾫�������ڱ��⿼��ķ�Ӧ�Ⱥ��ʱ�ͻ�ѧƽ��ļ��㣬��Ҫ�˽��ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ���Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%���ܵó���ȷ�𰸣�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֱ��������ͨʽ����CnH2n+2��ʾ������һϵ�з��������������ص����У� ![]() ��
��  ��
�� 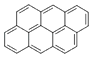 �������÷���ʽ��ʾ��һϵ�л�������ʮ����ӦΪ�� ��
�������÷���ʽ��ʾ��һϵ�л�������ʮ����ӦΪ�� ��
A.C15H24
B.C94H36
C.C60H36
D.C34H96
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D���ֵ��������ٵ�A��ʧȥ3�����Ӻ��Ӳ�ṹ����ԭ�ӵ���ͬ����B���õ�һ�����Ӻ�����Ӳ�ṹ���ԭ����ͬ����C����������λ����ɣ������ڱ�����A�������ڣ���D����18�����ӣ�����Ȼ���к�������Ԫ��λ��ͬһ���壮��ش�
��1��д�������ķ��ţ�A��B��C��D ��
��2��B���Ľṹʾ��ͼΪ��D���ĺ�������Ų�ʽΪ ��
��3������Ԫ�ص�һ�����ܵĴ�С˳��Ϊ�� ��
��4������Ԫ�ص縺�ԵĴ�С˳��Ϊ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�з����ӳɷ�Ӧ���ǣ�������
A. ����������ˮ�У���ˮ��ӽ���ɫ
B. ��ϩʹ���Ը��������Һ��ɫ
C. ��ϩͨ����ˮ�У���ˮ��ɫ
D. �����¼����������Ļ��������ɫ��dz
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����ǻ�����������˵���У�����ȷ���ǣ� ��
A. �ǻ�����������һ������
B. ���ߵ����Ԫ����ͬ
C. �ǻ������磬��������һ����λ�����
D. �ǻ����������ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʽṹͼ�У������ԭ��������1��10��Ԫ�ص�ԭ��ʵ��ԭ��ʵ��ԭ�ӳ�ȥ�������Ӻ�ʣ��IJ��֣���С�ڵ�������γɹ��ۼ���������������ӣ����ߴ������ۼ�����F2�� ![]() ��
�� 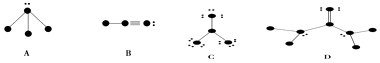
��1����д������ͼʾ�������Ļ�ѧʽ��A �� B �� C �� D ��
��2���������������ʵ�Һ���ϸ�����£��ô�����IJ���������ϸ����ϸ������ƫת�������A����B����C����D������
��3��B�����������ļ������м���
��4��C�����У�����ԭ���ӻ���������ӿռ乹���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ���� Na2CO3�� KHCO3 ��ɵ�ij��������ʵ�飬���������ݣ���������ʵ���Ũ������Ҳ�����HCl�Ļӷ��������йص�˵���У���ȷ���ǣ�������
ʵ����� | �� | �� | �� | �� |
�������/mL | 50 | 50 | 50 | 50 |
��������/g | 3.06 | 6.12 | 9.18 | 12.24 |
�����������/L������� | 0.672 | 1.344 | 1.568 | 1.344 |
A.��������ʵ���Ũ��Ϊ 2 molL��1
B.ԭ�������Ʒ�� n��Na2CO3����n��KHCO3��=1��1
C.ʵ����У���������
D.ʵ��ܷ�Ӧ��������������� 40ml �ĸ�������Һ���ܰ�12.24g �Ļ����ȫ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ�ã��гּ������������ԣ���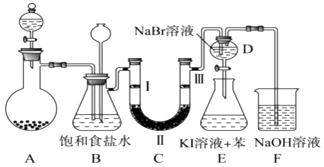
��1������������̺�Ũ�����Ʊ������Ļ�ѧ��Ӧ����ʽΪ�� �� װ��B�б���ʳ��ˮ����������ͬʱװ��B���ǰ�ȫƿ�����ʵ�����ʱC���Ƿ�����������д����������ʱB�е����� ��
��2��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C�Т����η��� �� ������ţ�
a | b | c | d | |
�� | �������ɫ���� | �������ɫ���� | ʪ�����ɫ���� | ʪ�����ɫ���� |
�� | ��ʯ�� | �轺 | Ũ���� | ��ˮ�Ȼ��� |
�� | ʪ�����ɫ���� | ʪ�����ɫ���� | �������ɫ���� | �������ɫ���� |
��3�����װ��D,E��Ŀ���DZȽ��ȡ��塢�ⵥ�ʵ�������ǿ��������D�л���ͨ����������ʱ�����Կ�����ɫ��Һ��Ϊ�Ȼ�ɫ��˵��Cl2������Br2���������=������������װ��D��������Һ����װ��E�У����۲쵽�������� ��
��4��װ��F����������NaOH��Һ�������ȣ���д����Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�����ȫȼ�պ�����CO2��H2O��SO2���û�������ܲ����е�Ԫ����(����)
A. C B. H
C. O D. S
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com