
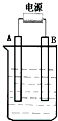
 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:分析 (1)电解质溶液为蓝色溶液,含有Cu2+,用石墨作电极电解观察到A电极表面有红色的固态物质生成,析出的红色固体为Cu,则A为阴极,连接电源的负极,B为阳极,发生氧化反应,B电极有无色气体生成,溶液中水放电生成氢气;
(2)电解时铜离子、水均放电,反应生成Cu、氧气与氢离子;
(3)计算Cu的物质的量,根据电极反应式计算生成氢离子物质的量,计算溶液中氢离子浓度,再根据pH=-lgc(H+)计算溶液pH;析出的物质相当于CuO,加入CuO可以使电解后溶液恢复到电解前的状态,根据Cu元素守恒计算需要加入CuO的质量;
(4)用惰性电极电解酸性MnSO4溶液可制得MnO2,阳极发生氧化反应,Mn2+失去电子转化为MnO2,由氧元素守恒可知有水参与反应,配平书写电极反应式.
解答 解:(1)电解质溶液为蓝色溶液,含有Cu2+,用石墨作电极电解观察到A电极表面有红色的固态物质生成,析出的红色固体为Cu,则A为阴极,连接电源的负极,B为阳极,发生氧化反应,B电极有无色气体生成,溶液中水放电生成氢气,阳极电极反应式为:4OH--4e-=2H2O+O2↑,
故答案为:负;阳;4OH--4e-=2H2O+O2↑;
(2)电解时铜离子、水均放电,反应生成Cu、氧气与氢离子,电解时反应的总离子方程式:2Cu2++2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,
故答案为:2Cu2++2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+;
(3)析出Cu的物质的量为$\frac{1.6g}{64g/mol}$=0.025mol,由2Cu2++2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+可知,得到氢离子为0.025mol×2=0.05mol,则c(H+)=$\frac{0.5mol}{0.5L}$=0.1mol/L,溶液pH=-lgc(H+)=1,
析出的物质相当于CuO,加入CuO可以使电解后溶液恢复到电解前的状态,由Cu元素守恒可知,加入CuO为0.025mol,需要加入CuO的质量为0.025mol×80g/mol=2g,
故答案为:1;A;2g;
(4)用惰性电极电解酸性MnSO4溶液可制得MnO2,阳极发生氧化反应,Mn2+失去电子转化为MnO2,由氧元素守恒可知有水参与反应,阳极电极反应式为:Mn2++2H2O-2e-═MnO2+4H+,
故答案为:Mn2++2H2O-2e-═MnO2+4H+.
点评 本题考查电解原理、电解反应式书写、电解有关计算等,侧重考查学生分析能力与计算能力,关键是明确电解工作原理,难度中等.


 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | F-的结构示意图: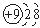 | B. | O-18的原子符号:${\;}_{10}^{18}$O | ||
| C. | NaCl的电子式: | D. | N2的结构式::N≡N: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红色、黑色、白色 | B. | 红色、白色、白色 | C. | 红色、红色、红色 | D. | 黑色、红色、白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的电子式: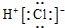 | B. | CO2分子的结构式:O=C=O | ||
| C. | Na的原子结构示意图: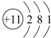 | D. | 钙离子的电子式:Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
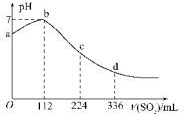 标准状况下,某同学向100mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )
标准状况下,某同学向100mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )| A. | 亚硫酸是比氢硫酸更弱的酸 | |
| B. | ab段反应是:SO2+2H2S═3S↓+2H2O | |
| C. | 原H2S溶液的物质的量浓度为0.05 mol/L | |
| D. | b点对应的溶液导电性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com