
| A. | C2H4O | B. | C2H6O | C. | C3H4O2 | D. | C3H6O2 |
分析 由乙醇C2H6O分子中C、H的个数,可确定A的分子式为C3H4Ox,再由消耗O2相等,即2+$\frac{6}{4}$-$\frac{1}{2}$=3+$\frac{4}{4}$-$\frac{X}{2}$,可确定A中氧原子数,以此可确定A的分子式.
解答 解:由乙醇C2H6O分子中C、H的个数,可确定A的分子式为C3H4Ox,再由消耗O2相等,即2+$\frac{6}{4}$-$\frac{1}{2}$=3+$\frac{4}{4}$-$\frac{X}{2}$,可确定A中氧原子为2,所以有机物A的分子式为C3H4O2,
故选:C.
点评 本题考查有机物分子式的确定,难度不大,解答本题时注意从反应的化学方程式的角度分析,注意CO2和H2O的物质的量的关系.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:选择题
在某恒温恒容的密闭容器内发生反应:2A(g)+B(g)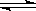 C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
A.再充入2mol A,平衡正移,A的转化率增大
B.如果升高温度,C的体积分数增大
C.如果增大压强,化学平衡一定向正反应方向移动,B的体积分数减小
D.再充入1mol C,C的物质的量浓度将增大
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
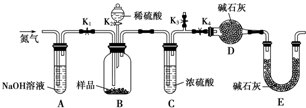
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
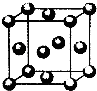 现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的族序数与周期数的差为4,且不与A元素在同一周期 |
| E位于周期表中第七列 |
| F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HCl、H2SO4中放出H2的速率相同 | |
| B. | CH3COOH中放出H2的速率最快 | |
| C. | H2SO4中放出H2的速率最快,CH3COOH中放出H2的速率最慢 | |
| D. | H2SO4中放出H2的量最多,其余的相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
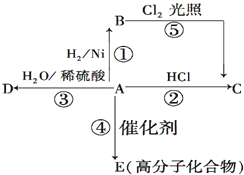 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应. (反应类型加聚反应 ).
(反应类型加聚反应 ).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
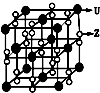 X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,Y和Z的单质可以通过分离液态空气的方法大量制得,且XZ2与Y2Z互为等电子体.含U的化合物的焰色为紫色.试回答下列问题:
X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,Y和Z的单质可以通过分离液态空气的方法大量制得,且XZ2与Y2Z互为等电子体.含U的化合物的焰色为紫色.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com