
(12分)某小组进行铝热反应实验,装置如图所示。
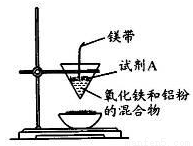
(1)铝热反应原理____(写化学方程式);试剂A为____(写化学式).实验现象____、有黑色固体生成。
(2)对黑色固体物质的组成,小组进行了如下探究
假设I该黑色物质为铁
假设Ⅱ该黑色物质为铁与四氧化三铁的混合物
【设计方案并实验】
实 验 步 骤 | 现 象 | 结 论 |
①取少量黑色固体于试管中加稀盐酸 | 固体全部溶解,有气泡产生 | 假设I成立,假设Ⅱ不成立 |
②滴入几滴0.01mol/LKSCN溶液 | 溶液不变色 |
【交流评价】
你认为上述结论是否合理,__ __理由是__ __。
(3)取上述实验所得溶液,滴人适量氯水溶液变红色。此时涉及的离子反应方程式为
__ __、__ __;
利用反应体系中存在的平衡,小组再将溶液均分置于两支试管中并分别编号l、2.进行
如下探究:
实验编号 | 实验步骤 |
1 | ①滴加饱和FeCl3溶液4滴,充分振荡 |
②滴加几滴NaOH溶液 | |
| ①滴加4滴1mol/LKSCN溶液 |
②滴加几滴NaOH溶液 |
该实验中,小组
主要探究的问题是__ __;
应重点观察的现象是__ __
预计得出的结论是__ __。
(1)Fe2O3+2Al Al 2O3+2 Fe KClO3(或Na2O2) 火星四射 有强光(或放出大量的热)
Al 2O3+2 Fe KClO3(或Na2O2) 火星四射 有强光(或放出大量的热)
(2)不合理 Fe3O4与酸反应生成的Fe3+与Fe反应生成Fe2+,滴入KSCN溶液后也不变色
(3)2 Fe2++Cl2=2 Fe3++2Cl- Fe3++3SCN- Fe(3SCN)3
Fe(3SCN)3
浓度对化学平衡的影响
溶液颜色的变化
增大反应物的浓度,平衡向正反应方向移动;减小反应物浓度,平衡向逆反应方向移动
【解析】
试题分析:(1)铝热反应的原理是铝与金属氧化物反应制取其他金属单质,所以铝与氧化铁的化学方程式为Fe2O3+2Al Al 2O3+2 Fe;试剂A为镁的燃烧提供氧化剂,所以试剂A是KClO3(或Na2O2),实验现象是镁燃烧时火星四射、有强光(或放出大量的热);
Al 2O3+2 Fe;试剂A为镁的燃烧提供氧化剂,所以试剂A是KClO3(或Na2O2),实验现象是镁燃烧时火星四射、有强光(或放出大量的热);
(2)该实验方案不合理,因为若为假设II,则在步骤①中若Fe过量,四氧化三铁与盐酸反应生成的铁离子与Fe反应也生成Fe2+,滴入KSCN溶液后也不变色,所以不合理;
(3)氯水中的氯气可以氧化亚铁离子为铁离子,铁离子与SCN-反应溶液变红色,离子方程式为2 Fe2++Cl2=2 Fe3++2Cl-;Fe3++3SCN- Fe(3SCN)3
Fe(3SCN)3
铁离子与SCN-存在平衡Fe3++3SCN- Fe(3SCN)3,根据实验步骤判断,滴加饱和氯化铁溶液目的是增大反应物的浓度,滴加氢氧化钠溶液,目的是降低铁离子的浓度,观察溶液颜色的变化,从而判断平衡移动的方向,所以该实验主要探究的问题是浓度对化学平衡的影响;应重点观察的现象是溶液颜色的变化;预计得出的结论是增大反应物的浓度,平衡向正反应方向移动;减小反应物浓度,平衡向逆反应方向移动。
Fe(3SCN)3,根据实验步骤判断,滴加饱和氯化铁溶液目的是增大反应物的浓度,滴加氢氧化钠溶液,目的是降低铁离子的浓度,观察溶液颜色的变化,从而判断平衡移动的方向,所以该实验主要探究的问题是浓度对化学平衡的影响;应重点观察的现象是溶液颜色的变化;预计得出的结论是增大反应物的浓度,平衡向正反应方向移动;减小反应物浓度,平衡向逆反应方向移动。
考点:考查对实验方案的评价,铝热反应,浓度对化学平衡的影响


科目:高中化学 来源:2015届安徽师大附中高二下学期期中考查化学试卷(解析版) 题型:填空题
实验室利用如图装置进行中和热的测定。回答下列问题:

(1)该图中有两处实验用品未画出,它们是 、 ;
(2)在操作正确的前提下提高中和热测定的准确性的关键是: 。
(3)如果用0.5mol?L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将 (填“偏大”、“偏小”、“不变”)原因是 。
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三入学考试化学试卷(解析版) 题型:选择题
关于氧化还原反应10AgF+5C12+5H2O==9口+AgClO3+10HF+O2,下列说法不正确的是
A.每生成1 mol O2,该反应转移电子的物质的量是4NA
B.该反应中Cl2既是氧化剂,又是还原剂
C.口中的物质是AgCl
D.该反应消耗的水有2/5被氧化
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都市高新区高三9月月考化学试卷(解析版) 题型:选择题
美国圣路易斯大学研制了一种新型的乙醇电池,用质子(H+)溶剂,在200oC左右时供电。电池总反应为:C2H5OH +3O2=2CO2 +3H2O,电池示意如下图,下列说法正确的是

A.a极为电池的正极
B.电池工作时电子由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ + O2 + 4e=2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都市高新区高三9月月考化学试卷(解析版) 题型:选择题
下列化学式能准确表示物质分子组成的是
A.NH4Cl B.C6H5NO2 C.SiO2 D.Cu
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都市2012级临诊考试化学试卷(解析版) 题型:填空题
(9分)W、X、Y、Z为原于序数依次增大的前四周期元素,其中W、X、Y为主族元素。用X的氧化物漂白的草帽日久又变成黄色;基态W原子有两个单电子,且与X不同周期不同族,X、Y同周期,基态Z原于电子分属7个能级,且各能级均为全充满。
(1)X基态原子的价电子排布式是 。
(2)WX2中W原子的杂化轨道地 类型是 ;WX2分子的立体构性为 。
(3)WX2 属于 (填“极性”或“非极性”“)分子;若X2Y2的结构简式为Y—X—X—Y,1molX2Y2含有的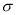 键数目为 NA。
键数目为 NA。
(4)X与Z所形成的化合物晶体的晶胞如下图所示,X的配位数是 ;该 晶体的化学式为 。

查看答案和解析>>
科目:高中化学 来源:2015届四川省成都市2012级临诊考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子一定能大量共存的是
A.c(Fe3+) =0.1mol·L-1的溶液中:K+、NH4+、SCN-、SO42-
B.水电离出的(OH-)=1。0×10-3 mol·L-1的溶液:Na+ 、K+、MnO4-、C2O42-
C.能与铝反应生成氢气的溶液中:K+、Cl- 、Na+、SiO32-
D.0 1 mol·L-1NaOH溶液K+、Na+、SiO32-、CO32-
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三8月开学测试化学试卷(解析版) 题型:实验题
(8分)实验室用乙酸和正丁醇制备乙酸正丁酯的原理如下:
CH3COOH+CH3CH2CH2CH2OH  CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
有关物质的物理性质如下表,请回答有关问题。
化合物 | 密度/g·cm-3 | 沸点/℃ | 溶解度/g |
正丁醇 | 0.810 | 118.0 | 9 |
冰醋酸 | 1.049 | 118.1 | ∞ |
乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
Ⅰ.乙酸正丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入11.5 mL正丁醇和9.4 mL冰醋酸,再加3~4滴浓硫酸,然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及冷凝回流管,加热冷凝回流反应。
(1)沸石的作用
________________________________________________________________________。
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是
__________________ ____________;
________________________________________________________________________。
Ⅱ.乙酸正丁酯粗产品精制
(3)将乙酸正丁酯粗产品用如下的操作进行精制:①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用10%碳酸钠溶液洗涤。正确的操作步骤是________(填字母)。
A.①②③④ B.③①④② C.①④①③② D.④①③②③
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市元宝山区高二上学期期末化学试卷(解析版) 题型:选择题
已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8kJ·mol-1
②Fe2O3(s)+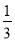 CO(g)=
CO(g)= 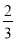 Fe3O4(s)+
Fe3O4(s)+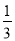 CO2(g) ΔH=-15.73kJ·mol-1
CO2(g) ΔH=-15.73kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4kJ·mol-1
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
A.-218kJ·mol-1 B.-109kJ·mol-1
C.+218kJ·mol-1 D.+109kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com