
 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$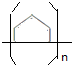 .
. +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$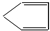 +2NaBr+2H2O.
+2NaBr+2H2O. +Br2→
+Br2→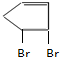 、
、 +Br2→
+Br2→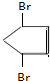 .
. 分析 烃A和溴发生加成反应生成二溴衍生物B,说明A是烯烃,B用热的NaOH乙醇溶液处理得到化合物C,经测试知C的化学式中含有两个双键,则B发生消去反应生成C,C的化学式为C5H6,将C催化加氢生成环戊烷,则C结构简式为 ,B为
,B为 、则A为
、则A为 ,结合题目分析解答.
,结合题目分析解答.
解答 解:烃A和溴发生加成反应生成二溴衍生物B,说明A是烯烃,B用热的NaOH乙醇溶液处理得到化合物C,经测试知C的化学式中含有两个双键,则B发生消去反应生成C,C的化学式为C5H6,将C催化加氢生成环戊烷,则C结构简式为 ,B为
,B为 、则A为
、则A为 ,
,
(1)A为 ,A发生加聚反应的化学方程式为n
,A发生加聚反应的化学方程式为n $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ ,
,
故答案为:n $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ ;
;
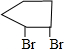
(2)C为 ,B为
,B为 ,B和氢氧化钠的醇溶液共热得到C,B→C反应的化学方程式为
,B和氢氧化钠的醇溶液共热得到C,B→C反应的化学方程式为 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O,
+2NaBr+2H2O,
故答案为: +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O;
+2NaBr+2H2O;
(3)C与等物质的量Br2发生加成反应的化学方程式为 +Br2→
+Br2→ 、
、 +Br2→
+Br2→ ,
,
故答案为: +Br2→
+Br2→ ;
; +Br2→
+Br2→ .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,以环戊烷为突破口结合反应条件、某些物质结构进行推断,注意(3)中二烯烃发生加成反应特点,题目难度不大.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z>W | |
| B. | ZW2电子式为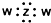 | |
| C. | 片状Y在空气中点燃时现象不剧烈 | |
| D. | 已知XW2熔点为-107℃、沸点为12.5℃,熔融时不导电,可说明固态XW2为共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥⑧ | B. | ②③⑤⑥⑦ | C. | ②③④⑥⑧ | D. | ①③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应时形成新化学键释放的能量大于断裂旧化学键所吸收的能量,则该化学反应是释放能量的反应 | |
| B. | 若反应物的总能量大于生成物的总能量,则该化学反应为释放能量的反应 | |
| C. | 化学反应中能量变化的大小与反应物的质量多少无关 | |
| D. | 化学反应必然伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 预期现象和结论 |
| 取少许吸收液于试管中滴加1~2滴0.01mol•L-1KMnO4溶液 | 若溶液褪色则假设1成立,否则假设1不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| 1.将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,做不定向运动,随之消失,溶液变成红色. |
| 2.向新制得的Na2S溶液中滴加少量新制的氯水 | B.有气体产生,溶液变成浅红色 |
| 3.将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| 4.将镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
| 5.将铝条投入稀盐酸中 | E.生成淡黄色沉淀 |
| 实验内容 | 实验现象 | 离子方程式 |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | ||
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com