
| �� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 2 | �� | �� | �� | �� | �� | |||
| 3 | �� | �� | �� | �� |
 ��Ԫ�آ��γɵ��⻯��ĵ���ʽ
��Ԫ�آ��γɵ��⻯��ĵ���ʽ ��
������ ��Ԫ�������ڱ���λ�ÿ�֪���١���ֱ�ΪLi��C��O��F��Ne��Na��Mg��S��Cl��
��1��������֮��F�ķǽ�������ǿ��Na�Ľ�������ǿ��
��2��O��ԭ������Ϊ8�����γɵ��⻯��ΪHCl��
��3���ǽ�����Խǿ����Ӧ�⻯��Խ�ȶ���
��4���ǽ�����Խǿ����Ӧ����������Ӧˮ���������Խǿ��
��5�����Ӳ�Խ�࣬ԭ�Ӱ뾶Խ��ͬ���ڴ�������ԭ�Ӱ뾶��С��
��� �⣺��Ԫ�������ڱ���λ�ÿ�֪���١���ֱ�ΪLi��C��O��F��Ne��Na��Mg��S��Cl��
��1������Ԫ��F�ķǽ�������ǿ��Ԫ��Na�Ľ�������ǿ���ʴ�Ϊ��F��Na��
��2��O��ԭ�ӽṹʾ��ͼΪ ��Ԫ�آ��γɵ��⻯��ΪHCl�������ʽΪ
��Ԫ�آ��γɵ��⻯��ΪHCl�������ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
�� ��
��
��3������Ԫ�آܡ����γɵ��⻯����ȶ���˳��ΪHF��HCl���ʴ�Ϊ��HF��HCl��
��4������Ԫ�آ�͢������������Ӧˮ���������ǿ��ΪHClO4��H2SO4���ʴ�Ϊ��HClO4��H2SO4��
��5������Ԫ�آۡ��ܡ��ޡ��ߵ�ԭ�Ӱ뾶��СΪNa��Mg��O��F���ʴ�Ϊ��Na��Mg��O��F��
���� ���⿼��λ�á��ṹ�����ʣ�Ϊ��Ƶ���㣬����Ԫ�ص�λ�á����ʡ�Ԫ��������Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע�������֪ʶ��Ӧ�ã���Ŀ�ѶȲ���


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 8 �� | B�� | 9 �� | C�� | 10 �� | D�� | 12 �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶ȣ�K�� | ƽ��ʱNH3�����ʵ�����mol�� |
| T1 | 2.4 |
| T2 | 2.0 |


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼��������Һ�еμ�����������Һ | B�� | ��������Һ�еμ����軯����Һ | ||
| C�� | �Ȼ�������Һ�еμ���ˮ | D�� | �Ȼ�����Һ�м��뻹ԭ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| B | C |
| D |
| A�� | �����ӵİ뾶��С��ϵ��C��E | |
| B�� | DԪ�ص���̬�⻯���CԪ�ص���̬�⻯���ȶ� | |
| C�� | ��A��B��C����Ԫ����ɵ����ӻ������У����������Ӹ�����Ϊ1��1 | |
| D�� | ��C��D��E����Ԫ����ɵĻ�����ֻ��һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
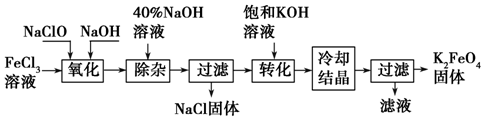
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ����÷����к���̼̼��������ĿΪ��������
����÷����к���̼̼��������ĿΪ��������| A�� | 3 | B�� | 2 | C�� | 4 | D�� | 1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com