
【题目】某溶液X中仅可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是
中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是 ![]()
![]()
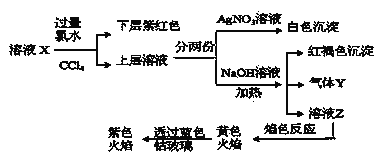
A.该溶液X中可能有![]() 、
、![]()
B.该溶液可能由是硫酸亚铁、碘化钾和氯化铵溶于水后得到的
C.如果气体Y能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有![]()
D.取样溶液Z,滴加氯化钡溶液出现沉淀,可推出X中一定存在![]() 、
、![]() 中的某一种
中的某一种
【答案】B
【解析】
由实验流程图可知,原溶液中加入过量氯水,向反应后的溶液加入CCl4萃取,下层呈紫红色,则原溶液中含有I-,但与Fe3+不能同时存在于溶液中,即原溶液中无Fe3+;此时上层的水溶液中一定含有氯水还原生成的Cl-,所以不能确定Cl-是否存在于原溶液中;
另外一份加入NaOH产生红褐色沉淀说明溶液中存在Fe3+,那只能是Fe2+被氯水氧化生成的Fe3+,所以原溶液中含有Fe2+,Fe2+与SO32-、CO32-不共存,则原溶液中无SO32-、CO32-,同时加热产生气体Y,则Y为NH3,则原溶液中含有NH4+;溶液Z的焰色反应为黄色说明含钠离子,但开始时加入了NaOH,则不能确定原溶液中是否含Na+,透过钴玻璃观察焰色反应为紫色火焰证明一定含K+;由于溶液中各离子浓度相等,即物质的量相等,设离子物质的量为1mol,正电荷总数:![]() ,根据溶液电荷守恒可知,原溶液中一定含有SO42-和Cl-,负电荷总数
,根据溶液电荷守恒可知,原溶液中一定含有SO42-和Cl-,负电荷总数![]() ,所以溶液中没有Na+;综上原溶液中一定含有K+、Fe2+、NH4+、SO42-、I-、Cl-,一定没有Fe3+、Na+、SO32-、CO32-,据此分析解答。
,所以溶液中没有Na+;综上原溶液中一定含有K+、Fe2+、NH4+、SO42-、I-、Cl-,一定没有Fe3+、Na+、SO32-、CO32-,据此分析解答。
原溶液中加入过量氯水,向反应后的溶液加入![]() 萃取,下层呈紫红色,则原溶液中含有
萃取,下层呈紫红色,则原溶液中含有![]() ,根据共存无
,根据共存无![]() ;由于开始时加入了过量氯水,此时不能确定
;由于开始时加入了过量氯水,此时不能确定![]() 存在;另外一份加入NaOH、加热产生红褐色沉淀说明原溶液中含有被氯水氧化生成
存在;另外一份加入NaOH、加热产生红褐色沉淀说明原溶液中含有被氯水氧化生成![]() 的
的![]() ,根据共存原溶液中无
,根据共存原溶液中无![]() 、
、![]() ,同时产生气体Y,则Y为
,同时产生气体Y,则Y为![]() ,则原溶液中含有
,则原溶液中含有![]() ;由于开始时加入了NaOH,则不能确定原溶液中是否含
;由于开始时加入了NaOH,则不能确定原溶液中是否含![]() ,透过蓝色钴玻璃观察焰色反应为紫色火焰证明一定含
,透过蓝色钴玻璃观察焰色反应为紫色火焰证明一定含![]() ;由于溶液中各离子浓度相等,即物质的量相等,设离子物质的量为1mol,正电荷总数:
;由于溶液中各离子浓度相等,即物质的量相等,设离子物质的量为1mol,正电荷总数:![]() ,根据溶液电中性可知,原溶液中含有
,根据溶液电中性可知,原溶液中含有![]() 和
和![]() ,并且负电荷总数
,并且负电荷总数![]() ,所以溶液中没有
,所以溶液中没有![]() ,综上原溶液中一定含有
,综上原溶液中一定含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,一定没有
,一定没有![]() 、
、![]() 、
、![]() 、
、![]() ,
,
A、根据上述分析可知,一定没有![]() 、
、![]() ,故A错误;
,故A错误;
B、原溶液中一定含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,则溶质可能为硫酸亚铁、碘化钾和氯化铵,故B正确;
,则溶质可能为硫酸亚铁、碘化钾和氯化铵,故B正确;
C、如果气体Y能使湿润的红色石蕊试纸变蓝,说明溶液中一定含有![]() ,故C错误;
,故C错误;
D、因为![]() 的存在,则X中不存在
的存在,则X中不存在![]() 故D错误;
故D错误;
故选:B。


科目:高中化学 来源: 题型:
【题目】“84”消毒液能有效杀灭甲型H1N1等病毒,某同学购买了一瓶“威露士”牌“84”消毒液,并查阅相关资料和消毒液包装说明得到如下信息:含25%NaClO、1000mL、密度1.19g·cm-3,稀释后使用。
请根据信息和相关知识回答下列问题:
(1)该“84”消毒液的物质的量浓度为__mol·L-1。
(2)该同学取100mL该“84”消毒液,加入10000mL水进行稀释,稀释后的溶液中c(Na+)=__mol·L-1。(假设稀释后溶液密度为1.0g·cm-3)
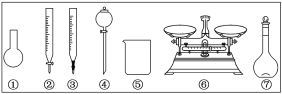
(3)该同学参阅该“84”消毒液的配方,欲用NaClO固体配制480mL含25%NaClO的消毒液。下列说法正确的是__。
A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143.0g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为药用有机物,存在如图所示的转化关系。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基处于邻位,D能跟NaOH溶液反应。

请回答:
(1)A转化为B、C时,涉及的反应类型有____________________________________、_______________。
(2)E的两种同分异构体Q、R都能在一定条件下发生银镜反应,R能与Na反应放出H2,而Q不能。Q、R的结构简式为Q________________;R________________。
(3)D的结构简式为____________。
(4)写出A在加热条件下与NaOH溶液反应的化学方程式:______________________。
(5)已知:![]()
![]()
 请选用适当物质设计一种合成方法。用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式。
请选用适当物质设计一种合成方法。用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式。![]()
![]()
![]()
![]() 有机物A。
有机物A。
___________; ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(________)
A.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
B.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
C.由“C(s,石墨)=C(s,金刚石) ΔH=+1.9kJ·mol-1”可知,金刚石比石墨稳定
D.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
E.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。则2E1>E2
F.测定盐酸和氢氧化钠反应的中和热实验中,所用试剂可以是浓溶液
G.1molNaOH分别和1molCH3COOH、1molHNO3反应放出的热量:CH3COOH<HNO3
H.把铝条放入盛有过量稀盐酸的试管中,加入Na2SO4溶液不影响氢气产生速率
I.对于可逆反应,反应进行的净速率是正、逆反应速率之差
J.对于可逆反应,正、逆反应速率的比值是恒定的
K.探究温度对反应速率的影响时,应先将硫代硫酸钠溶液、硫酸溶液分别在水浴中加热,然后混合
L.已知:
共价键 | C-C | C=C | C-H | H-H |
键能/kJ·mol-1 | 348 | 610 | 413 | 436 |
则可以计算出反应![]() (g)+3H2(g)→
(g)+3H2(g)→![]() (g)的ΔH为-384kJ·mol-1
(g)的ΔH为-384kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
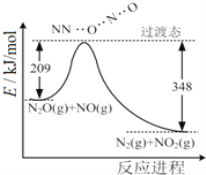
【题目】(1)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,其△H=___kJ·mol-1。
(2)已知:①C(s)+O2(g)=CO2(g) ΔH=akJ·mol-1
②CO2(g)+C(s)=2CO(g) ΔH=bkJ·mol-1
③Si(s)+O2(g)=SiO2(s) ΔH=ckJ·mol-1
工业上生产粗硅的热化学方程式为__。
(3)在烃分子中去掉2个氢原子形成一个双键是吸热反应,大约需117kJ/mol~125kJ/mol的热量,但1,3—环己二烯失去2个氢原子变成苯是放热反应,△H=-23.4kJ/mol,以上事实表明苯加氢生成环己烷是__反应。(填放热或吸热)
(4)X、Y两元素的原子,当它们分别获得两个电子形成稀有气体元素电子层结构时,X放出的热量大于Y放出的热量;Z、W两元素的原子,当它们分别失去一个电子形成稀有气体元素原子的电子层结构时,吸收能量W大于Z。则X、Y和Z、W分别形成的化合物中,离子化合物可能性最大的是__。(填化合物的化学式)
(5)称取等质量为(ag)胆矾两份。把一份溶于bg水中,测知其溶解时吸收Q1kJ热量;把另一份脱水后溶于bg水中,测得其溶解时放热Q2kJ。从以上数据可知,1mol胆矾脱水需__kJ热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A. 用铜电极电解硫酸铜溶液:2Cu2++2H2O![]() 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
B. 0.01 mol·L-1NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-==2BaSO4↓+Al(OH)3↓+NH3·H2O
C. 偏铝酸钠溶液中通入过量的二氧化碳:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. NaClO溶液和FeCl2溶液混合:2ClO-+Fe2++2H2O==Fe(OH)2↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质在相应的横线上。
品名 | ××× |
配料 | 鲜鸡蛋、精面粉、白砂糖、精炼植物油、奶油、奶粉、食盐、柠檬汁等 |
保质期 | 240天 |
生产日期 | 标于包装袋袋封口上 |
(1)富含蛋白质的物质是___________________________;
(2)富含糖类的物质是____________________________;
(3)富含油脂的物质是____________________________;
(4)富含维生素的物是___________________________。
Ⅱ.钢铁在潮湿的空气里很快就被腐蚀,原因是在钢铁的表面形成了一层电解质溶液的薄膜,跟钢铁里的铁和少量的碳构成无数微小的原电池,请写出两极发生的主要的电极式为:负极________________;正极_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.绝热恒容密闭容器中通入A和B,发生反应:2A(g)+B(g)2C(g),图为其正反应速率随时间变化的示意图,则该反应为放热反应

B.催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率如图显示的是催化反应与无催化反应过程中的能量关系

C.将BaO2放入密闭真空容器中,反应2BaO2(s)2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的一半,体系重新达到平衡,体系压强变化如图所示

D.将一定量的NO2充入针筒中后封口,发生反应2NO2(g)N2O4(g),如图表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化气体颜色越深,透光率越小。则c点与a点相比,c(NO2)增大,减小

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、铁是生产、生活及生命中的重要元素。
(1)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合能力。药品美蓝是其有效的解毒剂,解毒时美蓝发生_____反应(填“氧化”或“还原”)。
(2)普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生逆反应得到“引火铁”。 “引火铁”是一种极细的铁粉,它在空气中可以自燃,其原因是_____________。
Ⅱ、在1 L 2 mol·L-1稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入铁粉的物质的量的关系如图所示:

回答下列问题:
(1)写出加入n1mol铁所发生反应的离子方程式_______________________________。
(2)整个过程中转移电子的数目是________。
(3)若M点时再加入V L 2 mol·L-1的稀硝酸,恰好反应完全,则V为___________。
(4)研究表明硝酸的浓度越小,反应后氮的化合价越低。在极稀的硝酸溶液中加入少量铁粉,生成NH4+的离子方程式为___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com