
分析 (1)在NaOH的醇溶液中、加热条件下该溴代烷发生消去反应生成丙烯;
(2)能与金属钠反应,但不能与氢氧化钠反应的芳香族化合物C7H8O,说明该物质中含有醇羟基不含酚羟基;
(3)含C、H、O三种元素的有机物,燃烧时消耗的氧气和生成的CO2、H2O之间物质的量之比为1:2:2,该有机物为CnH2nOx,利用CnH2nOx+mO2$\stackrel{点燃}{→}$2mCO2+2mH2O分析;
(4)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成液态水和二氧化碳气体放热22.68kJ×32=725.8kJ;
(5)原电池中正极上得电子发生还原反应,根据方程式知,正极上铁离子得电子发生还原反应.
解答 解:(1)分子式为C3H7Br的卤代烃CH3CH2CH2Br或CH3CHBrCH3经消去反应后得到的有机物均为CH3CH=CH2,故答案为:CH3CH=CH2;
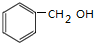
(2)能与金属钠反应,但不能与氢氧化钠反应的芳香族化合物C7H8O,为苯甲醇,结构简式为 ,故答案为:
,故答案为: ;
;
(3)含C、H、O三种元素的有机物,燃烧时消耗的氧气和生成的CO2、H2O之间物质的量之比为1:2:2,该有机物为CnH2nOx,则Cn(H2O)n+mO2$\stackrel{点燃}{→}$2mCO2+2mH2O,
所以$\frac{1}{2}$,解得x=2n,即有机物为CnH2nO2n,n=1为最简单的此类有机物,该物质为HCOOH,故答案为:HCOOH;
(4)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成液态水和二氧化碳气体放热22.68kJ×32=725.8KJ,反应的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol;
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol;
(5)原电池中正极上得电子发生还原反应,根据方程式知,正极上铁离子得电子发生还原反应,电极反应式为Fe3++e-=Fe2+,故答案为:Fe3++e-=Fe2+.
点评 本题考查较综合,涉及有机物结构和性质、热化学方程式的书写、原电池原理等知识点,明确官能团及其性质关系、热化学方程式书写规则及电极反应式书写方法是解本题关键,难点是(3)题计算,侧重考查学生分析计算能力,题目难度不大.


科目:高中化学 来源: 题型:多选题
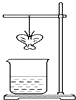 某同学用滤纸折成一个纸蝴蝶并喷洒一种溶液(保持湿润),挂在铁架台上.另取一只盛某种溶液的烧杯,放在纸蝴蝶的下方(如图).过一会,发现纸蝴蝶变为红色.如表的组合中,能够实现上述变化的是( )
某同学用滤纸折成一个纸蝴蝶并喷洒一种溶液(保持湿润),挂在铁架台上.另取一只盛某种溶液的烧杯,放在纸蝴蝶的下方(如图).过一会,发现纸蝴蝶变为红色.如表的组合中,能够实现上述变化的是( )| A | B | C | D | |
| 纸蝴蝶上的喷洒液 | 酚酞 | 酚酞 | 石蕊 | 石蕊 |
| 小烧杯中的溶液 | 浓氨水 | 浓NaOH | 浓盐酸 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和Al2(SO4)3溶液分别加热蒸发,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在盐酸中,然后再用水稀释到所需的浓度 | |
| C. | 中和热测定时,用铜制搅拌器代替玻璃环形搅拌器,测定的实验结果不变 | |
| D. | 室温时将Na2CO3溶液加水稀释后,再恢复至室温,pH和KW均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入少量稀H2SO4,在管口观察到红棕色气体 | 溶液中NO3-被Fe2+还原成NO2 |
| B | 用铂丝蘸取溶液进行焰色反应,观察到火焰呈黄色 | 该溶液一定是钠盐溶液 |
| C | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 有NaHCO3晶体析出 |
| D | 常温下,将Al箔插入浓硫酸中,无明显现象 | 铝和浓硫酸常温不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 | |
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠能与冷水剧烈反应,而铝不能与冷水反应 | |
| B. | NaOH易溶于水,Al(OH)3难溶于水 | |
| C. | 等物质的量的NaOH和Al(OH)3,Al(OH)3可以电离出更多OH- | |
| D. | 等物质的量铝比钠失去电子数多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X | |
| B. | X、Y和Z三种元素形成的化合物中一定含有离子键和共价键 | |
| C. | 化合物YX3溶解于水中促进了水的电离 | |
| D. | Y的最高价氧化物对应的水化物一定有强氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com