
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为_____________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
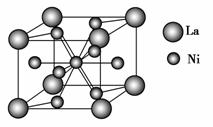
(3)NiO晶胞中Ni和O的配位数分别为________、________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。该合金的化学式为________。
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
实验:①0.1 mol·L-1AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;
③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是( )
A.浊液a中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl转化为AgI
D.实验可以证明AgI比AgCl更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的化学方程式或离子方程式不正确的是( )
A.工业上可用电解法制备Mg:MgCl2(熔融)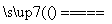 Mg+Cl2↑
Mg+Cl2↑
B.向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2===2HClO+CaCO3↓
C.用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)CaCO3(s)+Na2SO4(aq)
D.用FeSO4除去酸性废水中的Cr2O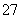 :Cr2O
:Cr2O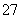 +Fe2++14H+===2Cr3++Fe3++7H2O
+Fe2++14H+===2Cr3++Fe3++7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
糖类和蛋白质在人类的生命活动过程中起重要作用,请根据糖类、蛋白质的有关性质回答下列问题:
Ⅰ.糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志。长期摄入高热量食品和缺少运动都易导致糖尿病。
(1)血糖是指血液中的葡萄糖(C6H12O6)。下列说法正确的是__________。
A.葡萄糖属于碳水化合物,分子式可表示为C6(H2O)6,则每个葡萄糖分子中含6个H2O
B.糖尿病人尿糖较高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
C.葡萄糖可用于制镜工业
D.淀粉水解的最终产物是葡萄糖
(2)木糖醇[CH2OH(CHOH)3CH2OH]是一种甜味剂,糖尿病人食用后不会升高血糖。请预测木糖醇的一种化学性质:__________________________________________________
__________________________________________________。
(3)糖尿病人宜多吃蔬菜和豆类食品。蔬菜中富含纤维素,豆类食品中富含蛋白质。下列说法错误的是______。(填序号)
A.蛋白质都属于天然有机高分子化合物,蛋白质都不溶于水
B.用灼烧闻气味的方法可以区别合成纤维和羊毛
C.人体内不含纤维素水解酶,人不能消化纤维素,因此蔬菜中的纤维素对人没有用处
D.紫外线、医用酒精能杀菌消毒,是因为可以使细菌的蛋白质变性
E.用天然彩棉制成贴身衣物可减少染料对人体的副作用
Ⅱ.某种蛋白质的结构片段如下:
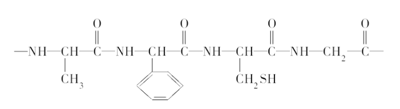
(4)上述蛋白质结构片段完全水解所生成的氨基酸是:
__________________________________________________。
(5)水解所生成的氨基酸中,碳、氢原子数比值最大的那一种与NaOH溶液反应的化学方程式为______________________,形成二肽的化学方程式为__________。
(6)已知上述蛋白质结构片段的相对分子质量是364,则水解生成的各种氨基酸的相对分子质量之和为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体的晶胞结构示意图如图所示,它的化学式是 ( )。
A.BaTi8O12 B.BaTi4O6
C.BaTi2O4 D.BaTiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
主族元素A和B可组成为AB2的离子化合物,则A、B两原子的最外层电子排布式分别为( )
A.ns2np2和ns2np4 B. ns1和ns2np4
C.ns2和ns2np5 D.ns1和ns2
查看答案和解析>>
科目:高中化学 来源: 题型:
关于同一种元素的原子或离子,下列叙述正确的是( )
A.原子半径比阴离子半径小
B.原子半径比阴离子半径大
C.原子半径比阳离子半径小
D.带正电荷多的阳离子比带正电荷少的阳离子半径大
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。

(1)下列________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力,②形成稳定结构的倾向。下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | 9 550 | 11 600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量:__________________________________________________。
②表中X可能为以上13种元素中的________(填写字母)元素,则该元素属于________区。用元素符号表示X和j所能形成的化合物的化学式是__________。
③Y是周期表中________族元素。
④以上13种元素中,________(填写字母)元素原子失去核外第一个电子需要的能量最多。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com