


 Al2O3+ 3H2O (3分)
Al2O3+ 3H2O (3分) Al2O3+ 3H2O。
Al2O3+ 3H2O。

科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊 | 该溶液中一定有CO32- |
| D | 用洁净的铂丝蘸取某溶液,在无色火焰上灼烧,观察到火焰颜色为黄色 | 该溶液中一定含有Na+,可能含有K+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 操作 | 现象 | 结论 |
| A. | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| B. | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| C. | 用洁净铂丝蘸取某溶液进行焰色反应 | 火焰呈黄色 | 溶液中有K+ |
| D. | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用过量氨水除去Al3+溶液中的少量Fe3+ |
| B.将混合气体通过灼热的铜网除去N2中的少量O2 |
| C.向某溶液中加HCl酸化的BaCl2溶液,产生白色沉淀,则该溶液中一定含有SO42- |
| D.向澄清石灰水中通入少量气体产生沉淀,过量时沉淀溶解,说明该气体一定是CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 药品名称 | 熔点/℃ | 沸点(℃) | 密度g/cm3 | 溶解性 |
| 正丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
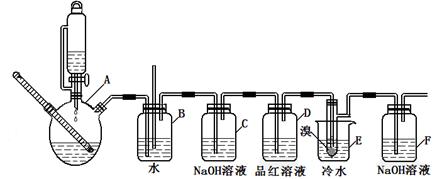
| | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.能耗大是该方法的一大缺点 |
| B.整个过程中,有两种物质可以循环利用 |
| C.捕捉到的CO2可用来制备甲醇等产品,可减少碳排放 |
| D.“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定含有SO42- |
| B.观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察 |
| C.待检液加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+ |
| D.待检液加入氯化钡溶液有白色沉淀生成, 再加入盐酸沉淀消失且产生无色无味的气体,则待检液中一定含有CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com