
| 温度(K) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| A. | △H=△H1-△H2 | |
| B. | K=$\frac{{K}_{1}}{{K}_{2}}$ | |
| C. | 该反应进行时不断分离出H2O,可以提高CO2的转化率和反应速率 | |
| D. | 该反应正反应为吸热反应 |
分析 A、①Fe(s)+CO2(g)?FeO(s)+CO(g);
②Fe(s)+H2O (g)?FeO(s)+H2 (g);
①-②得到H2(g)+CO2(g)?CO(g)+H2O(g),据此计算焓变;
B、①-②得到H2(g)+CO2(g)?CO(g)+H2O(g),据此写出平衡常数表达式K;
C、反应进行时不断分离出H2O,平衡向右移动,根据影响平衡移动和速率的因素来回答;
D、根据盖斯定律及题中热化学方程式判断反应③的反应热.
解答 解:A、①Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,
②Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,
根据盖斯定律可得:①-②可得,③H2(g)+CO2(g)?CO(g)+H2O(g)△H3=△H1-△H2,故A正确;
B、①-②得到H2(g)+CO2(g)?CO(g)+H2O(g),据此写出平衡常数表达式K=$\frac{{K}_{1}}{{K}_{2}}$,故B正确;
C、该反应进行时不断分离出H2O,平衡向右移动,可以提高CO2的转化率,但是反应速率减慢,故C错误;
D、根据表中数据可知,温度升高,反应①的平衡常数增大,说明该反应吸热,△H1>;升高温度反应②的平衡常数减小,该反应为放热反应,△H2<0,所以)△H3=△H1-△H2>0,反应为吸热反应,故D正确.
故选C.
点评 本题考查了化学平衡常数的计算、化学平衡常数的影响因素、盖斯定律的应用等知识,题目难度中等,注意掌握影响化学平衡的因素、化学平衡常数表达式及计算方法、盖斯定律的含有及应用,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Y元素形成的单核阴离子还原性强于X | |
| B. | Z元素的简单气态氢化物的沸点比Y高 | |
| C. | W元素氧化物对应的水化物的酸性一定强于Z | |
| D. | X的气态氢化物可与其最高价含氧酸反应生成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①④ | C. | ③⑥ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和NaOH溶液 | B. | NaAlO2和HCl溶液 | ||
| C. | NaHCO3溶液和HCl溶液 | D. | AgNO3溶液和氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH和C3H4 | B. | CH4和C3H4O | C. | CH4和C2H4 | D. | CH4和C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| 1 | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| 2 | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| 3 | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| A. | 实验1和实验2可以探究Na2S2O3浓度对反应速率的影响 | |
| B. | 实验1和实验3可以探究温度对反应速率的影响 | |
| C. | 通过测定单位时间内收集到气体的体积判断化学反应速率快慢 | |
| D. | 实验3时,应先分别将Na2S2O3溶液、H2SO4溶液和水置于热水浴中加热到所需温度再混合发生反应,记录反应所需时间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,l.6gCH4中含有共价键总数为0.4NA | |
| B. | 常温常压下,2.24 L NO2气体中含有NO2分子数为0.1NA | |
| C. | 1 L0.lmol•L-1的醋酸中含有H十离子数为0.1NA | |
| D. | 铝热反应中1 molFe3O4完全反应,转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 前者是混合物,后者是纯净物 | |
| B. | 两者都具有丁达尔效应 | |
| C. | 分散质的粒子直径均在1~100nm之间 | |
| D. | 前者可用于杀菌,后者可用于净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
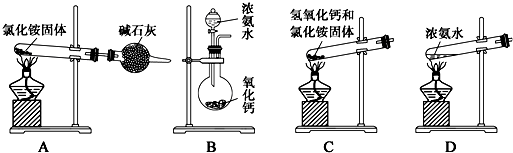
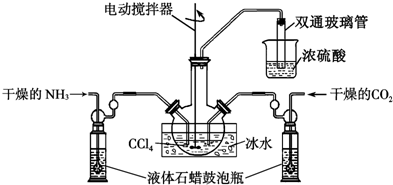
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com