
纳米氧化铝在陶瓷、电子、生物医药等方面有广泛的用途,它可通过硫酸铝铵晶体热分解得到.制备硫酸铝铵晶体的实验流程如下: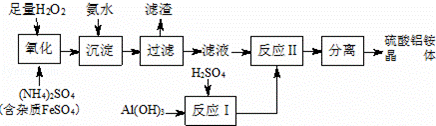
(1)H2O2氧化FeSO4的离子方程式为 2Fe2++H2O2+2H+=2Fe3++2H2O .
(2)加入氨水的目的是 Fe3+使转化为Fe(OH)3 ,其化学反应方程式为 Fe2(SO4)3+6NH3•H2O=2Fe(OH)3↓+3(NH4)2SO4 .
(3)若要保证产品的纯度,必须检验加入氨水后杂质是否除尽?其实验操作是:用试管取少量洗涤液, 加几滴KSCN溶液,若溶液不变红色 ,则说明滤渣已洗净.
(4)上述流程中,“分离”所包含的操作依次为: 蒸发浓缩 、 冷却结晶 、过滤、洗涤、干燥;请完成硫酸铝铵晶体高温分解的化学
方程式:2Al2(NH4)2(SO4)4•24H2O 2 Al2O3+ 4 NH3↑+ 8 SO3↑+ 26H2O .
2 Al2O3+ 4 NH3↑+ 8 SO3↑+ 26H2O .
(5)取4.53g 硫酸铝铵晶体加热分解,最终剩余0.51g Al2O3固体.加热过程中,固体质量随温度的变化如图所示.请计算确定400℃时(硫酸铵未分解)剩余固体成分的化学式为 (NH4)2Al2(SO4)4•H2O (不必写出计算过程).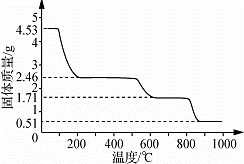
| 制备实验方案的设计.. | |
| 分析: | 由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后滤液主要含硫酸铵,氢氧化铝与硫酸混合反应生成硫酸铝溶液,再将硫酸铵和硫酸铝溶液混合反应,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等最终得到硫酸铝铵晶体, (1)由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+;反应的离子方程式为: (2)加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,一水合氨和铁离子反应生成氢氧化铁沉淀; (3)过滤后的滤液中可能含有Fe3+,用KSCN溶液检验是否含有Fe3+; (4)由工艺流程可知,流程中“分离”是从溶液中获得晶体,操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等,依据原子守恒配平书写化学方程式; (5)计算晶体中水的质量,根据固体质量差,计算晶体中剩余结晶水的质量,进而计算剩余固体中n:n(H2O),据此书写化学式. |
| 解答: | 解:由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后滤液主要含硫酸铵,氢氧化铝与硫酸混合反应生成硫酸铝溶液,再将硫酸铵和硫酸铝溶液混合反应,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等最终得到硫酸铝铵晶体; (1)由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,2Fe2++H2O2+2H+=2Fe3++2H2O, 故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O; (2)加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,反应的化学方程式为:Fe2(SO4)3+6NH3•H2O=2Fe(OH)3↓+3(NH4)2SO4, 故答案为:Fe3+使转化为Fe(OH)3 ;Fe2(SO4)3+6NH3•H2O=2Fe(OH)3↓+3(NH4)2SO4; (3)过滤后的滤液中可能含有Fe3+,取少许滤液于试管中,加几滴KSCN溶液,若溶液不变红色,则杂质已除尽, 故答案为:加几滴KSCN溶液,若溶液不变红色; (4)由工艺流程可知,流程中“分离”是从溶液中获得晶体,操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等,依据原子守恒配平得到化学方程式为:2Al2(NH4)2(SO4)4•24H2O 故答案为:蒸发浓缩;冷却结晶;2,8,4,26H2O; (5)取4.53g硫酸铝铵晶体的物质的量为 4.53g硫酸铝铵晶体中水的质量为0.005mol×24×18g/mol=2.16g, 加热400℃时固体质量减少△m=4.53g﹣2.46g=2.07g<2.16g 剩余固体中结晶水的物质的量为 剩余固体中n:n(H2O)=0.005mol:0.005mol=1:1, 故400℃时剩余固体成分的化学式为(NH4)2Al2(SO4)4•H2O. 故答案为:(NH4)2Al2(SO4)4•H2O. |
| 点评: | 本题考查镁铝及其化合物的性质,对工艺流程理解、常用化学用语、盐类水解、物质的分离提纯与离子检验、化学计算等,综合性较大,难度较高,需要学生具备扎实的基础与运用知识分析解决问题的能力. |


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
兰尼镍(Rancy-Ni)是一种带有多孔结构的细小晶粒组成的镍铝合金,广泛用作烯烃、氢化反应的催化剂。其高催化活性源于镍本身的催化性质和其多孔结构对氢气的强吸附性。以镍、铝为原料制备兰尼镍的工艺流程如下:
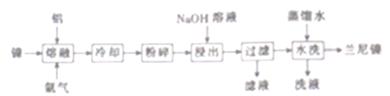
(1)“熔融”时通入氩气的目的是_____________________________________。
(2)“浸出”是整个流程的核心步骤,该步骤的目的是_____________________,发生反应的离子方程式为____________________________________。浸出反应所用NaOH溶液的浓度需达5mol·L-1以上,若用NaOH稀溶液浸出时,则会产生Al(OH)3沉淀阻止浸出反应持续进行,产生Al(OH)3的化学方程式为___________________________。
(3)滤液的主要成分与过量CO2反应的离子方程式为__________________。
(4)使用新制的兰尼镍进行氢化反应有时不需要加入氢气即可完成反应得到氢化产物,原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
醋硝香豆素是一种治疗心脑血管疾病的药物,可以通过以下方法合成(部分反应条件省略)
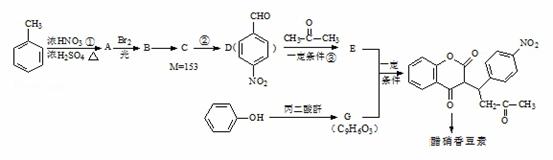
已知: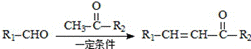 +H2O
+H2O
回答以下问题:
(1)反应①的反应类型是
(2)写出以下物质的结构简式:
B G
(3)反应②的化学方程式为
(4)反应③的化学方程式为
(5)关于E物质,下列说法正确的是 (填字母序号).
a.在核磁共振氢谱中有四组吸收峰 b.可以用溴水溶液鉴别D和E
c.可以发生加成反应、聚合反应、氧化反应和还原反应 d.存在顺反异构
(6)分子结构中只含有一个环,且同时符合下列条件的G的同分异构体共有 种
①可与氯化铁溶液发生显色反应; ②可与碳酸氢钠溶液反应生成二氧化碳气体。
其中,苯环上的一氯代物只有两种的同分异构体的结构简式为
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项叙述I、Ⅱ都正确且二者的原理最相似的是( )
| 叙述Ⅰ | 叙述Ⅱ | |
| A | FeS难溶于水,却溶于稀硝酸 | CaCO3难溶于稀硫酸,却溶于醋酸 |
| B | 浓硫酸要密封保存阴凉处 | 漂白粉要密封保存在阴凉处 |
| C | 盐酸与铁反应生成氯化亚铁 | 少量氯气与铁反应生成氯化亚铁 |
| D | 碳酸钠溶液显弱碱性 | 氯化铵溶液显弱酸性 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为__________.
(2)写出该反应的化学方程式____________________________________________.
若反应中生成0.2 mol HNO3,转移的电子数目为________个.
(3) 三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F 据题意推测 NF3,F2,NO三种气体中,氧化性由弱到强的顺序为
(4)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现.你判断该气体泄漏时的现象是___________________________________________________.
(5)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有____________________________(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
、对于H-+H2O===H2+OH-说法正确的是
A、该反应属于置换反应 B、若该反应中有1 mol电子转移,则生成H2是22.4 L
C、水是氧化剂 D、H2只是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
直链型的不饱和油酸(C17H33COOH)与蔗糖反应可以制得非天然油脂,其反应示意图如下所示(注:图的反应式不完整):
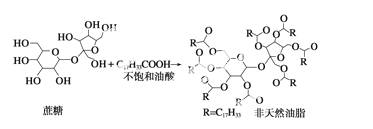
则下列说法不正确的是 ( )
A.甘油和蔗糖在一定条件下都可以发生消去反应
B.天然油脂、蔗糖、非天然油脂都能发生水解反应
C.该非天然油脂与氢氧化钠溶液共热,可以发生皂化反应,水解后的 产物可与溴的四氯化碳溶液反应
产物可与溴的四氯化碳溶液反应
D.植物油、非天然油脂都可以与H2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com