

分析 由流程可知,分离KCl和BaCl2两种固体混合物,可先溶于水,然后加入a为过量K2CO3使BaCl2转化为沉淀,过滤后沉淀A为碳酸钡,加入试剂b为盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,操作②所得滤液为KCl和K2CO3的混合物,应加入过量盐酸可得KCl,以此来解答.
解答 解:(1)将固体配成溶液,应加水溶解,操作②为固体和液体的分离,为过滤操作,故答案为:溶解;过滤;
(2)固体溶解后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,则试剂a为K2CO3,试剂b为HCl,
故答案为:K2CO3;HCl;
(3)加入试剂a,K2CO3与BaCl2反应生成BaCO3沉淀,反应为K2CO3+BaCl2═BaCO3↓+2KCl,发生的离子方程式为CO32-+Ba2+=BaCO3↓,
加入试剂b,BaCO3沉淀加入盐酸可生成BaCl2溶液,反应为BaCO3+2HCl═BaCl2+CO2↑+H2O,反应的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:K2CO3+BaCl2═BaCO3↓+2KCl;BaCO3+2HCl═BaCl2+CO2↑+H2O;
(4)由上述分析可知,该实验不能达到目的,因操作②的滤液中可能混有碳酸钾,应加过量盐酸后蒸发结晶,故答案为:不能;应在操作②的滤液中加入过量盐酸后再蒸发结晶.
点评 本题考查混合物分离提纯实验,为高频考点,把握流程中的化学反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L酒精所含分子数为0.5NA | |
| B. | 40gNaOH含有钠离子数为NA | |
| C. | 1 L NaCl溶液中,所含离子总数为2 NA | |
| D. | 标准状况下,22.4L氢气含有NA个氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NaOH+H2SO4=Na2SO4+2H2OB | B. | Cl2+H2O=HCl+HClO | ||
| C. | CaO+H2O=C a(OH)2 | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸不小心沾到皮肤上,立刻用NaOH溶液洗涤 | |
| B. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| C. | 实验室制取气体时应先检查装置的气密性 | |
| D. | 做氢气还原氧化铜的实验时先加热再通氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
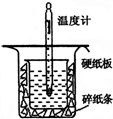 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由途径①和②分别制取1molFeCl2,理论上各消耗1molFe,各转移2mole- | |
| B. | 由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 molCl2,各转移2mole- | |
| C. | 由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1molS,各转移6mole- | |
| D. | 以上说法都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
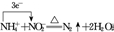 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com