

分析 (1)A中制备氯气,B中氯气与Fe加热条件下反应生成氯化铁,后面的硬质水管收集氯化铁,氯化铁易潮解,制备的氯气中含有水蒸气,需要进行干燥,C中浓硫酸干燥氯气,氯气有毒会污染空气,D吸收尾气中氯气,干燥管中氯化钙吸收水蒸气,防止加入B中;
(2)A中氯酸钾与浓盐酸反应生成氯化钾、氯气与水;
(3)装置中含有空气,B中加热时氧气能与Fe反应,先用氯气排尽装置中空气后,再反应制备氯化铁;
(4)C中浓硫酸干燥氯气;
(5)D中氢氧化钙与氯气反应生成氯化钙、次氯酸钙与水;
(6)①由滴定管的结构,应是碱式滴定管;
②用饱和的氯化钠溶液,降低氯气的溶解度;读数时应左右两边液面相平;
③第一次与最后读数之差为测定气体的体积,最后读数时俯视右边滴定管液面时,读数偏小,测定气体的体积偏大.
解答 解:(1)A中制备氯气,B中氯气与Fe加热条件下反应生成氯化铁,后面的硬质水管收集氯化铁,氯化铁易潮解,制备的氯气中含有水蒸气,需要进行干燥,C中浓硫酸干燥氯气,氯气有毒会污染空气,D吸收尾气中氯气,干燥管中氯化钙吸收水蒸气,防止加入B中,各装置的连接顺序为a→e→d→b→c→f;
故答案为:e;d;b;c;f;
(2)A中氯酸钾与浓盐酸反应生成氯化钾、氯气与水,反应方程式为:KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O;
故答案为:KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O;
(3)铁与氧气易反应,为防止B装置中空气中的氧气在加热时与铁发生反应,故应该先用氯气排尽装置中的空气;
故答案为:防止B装置中空气中的氧气在加热时与铁发生反应,故应该先用氯气排尽装置中的空气;
(4)生成的氯气中混有水蒸气,C装置中浓硫酸是用来干燥Cl2或者吸收Cl2中的水分;
故答案为:干燥Cl2或者吸收Cl2中的水分;
(5)D中氢氧化钙与氯气反应生成氯化钙、次氯酸钙与水,反应方程式为:2 Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O;
故答案为:2 Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O;
(6)①由滴定管的结构,所用滴定管为碱式滴定管;
故答案为:碱式;
②用饱和的氯化钠溶液,降低氯气的溶解度;读数时应上下移动滴定管,使左右两边液面相平,保持内外气压相等;
故答案为:饱和NaCl溶液;上下移动滴定管,使左右两边液面相平;
③滴定管刻度由上而下增大,最后读数时仰视右边滴定管液面时,读数偏大,第一次与最后读数之差为测定气体的体积,测定气体的体积偏小;
故答案为:偏小.
点评 本题考查物质制备实验,涉及氯气制备、对装置的分析评价、信息获取与迁移应用、气体体积测定等,关键是明确实验原理,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | O-H | C-H | C-O | C=O |
| 键能/KJ•mol-1 | 436 | 463 | 413 | 351 | 1076 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中将钠保存于煤油或石蜡油中 | |
| B. | 金属镁着火使用泡沫灭火器灭火 | |
| C. | 用湿润的淀粉-KI试纸鉴别NO2和溴蒸气 | |
| D. | 配制一定物质的量浓度的溶液时,向容量瓶中倒入液体至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
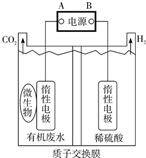 在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2,其原理如图所示,下列有关说法不正确的是( )
在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2,其原理如图所示,下列有关说法不正确的是( )| A. | 电极B极为负极 | |
| B. | 与电源A极相连的惰性电极上发生的反应为:CH3COOH-8e-+H2O=2CO2↑+8H+ | |
| C. | 通电后,H+通过质子交换膜向右移动,最终右侧溶液pH减小 | |
| D. | 通电后,若有0.1molH2生成,则转移0.2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W<X<Y<Z | |
| B. | 最高价氧化物对应水化物酸性:X>Y | |
| C. | W、X两种元素组成的化合物难溶于水 | |
| D. | W、Y、Z三种元素不能组成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
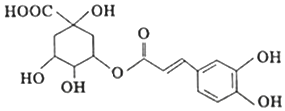
| A. | 绿原酸分子中有4种含氧官能团 | |
| B. | 绿原酸能发生取代、加成、消去和氧化反应 | |
| C. | 绿原酸在酸性条件下的水解产物均能与FeCl3发生显色反应 | |
| D. | l mol绿原酸与足量钠反应,可生成4 molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $\stackrel{铑催化剂}{→}$
$\stackrel{铑催化剂}{→}$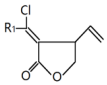 (R1代表氢原子或烃基)
(R1代表氢原子或烃基)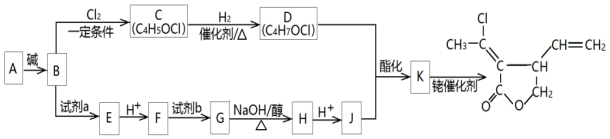
 +
+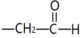 $\stackrel{碱}{→}$
$\stackrel{碱}{→}$ +H2O
+H2O .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com