
【题目】乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。
(1)电石水化法制乙炔是将生石灰与焦炭在3000℃下反应生成CaC2,CaC2再与水反应即得到乙炔。CaC2与水反应的化学方程式为___________________________。
(2)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-890.3 kJ/mol
C2H2(g)+2.5O2(g)===2CO2(g)+H2O(l) ΔH2=-1299.6 kJ/mol
2H2(g)+O2(g)===2H2O(l) ΔH3=-571.6 kJ/mol
则甲烷气相裂解反应:2CH4(g)===C2H2(g)+3H2(g)的ΔH=________kJ/mol。
(3)哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

①T1℃时,向1 L恒容密闭容器中充入0.3 mol CH4只发生反应2CH4(g) ![]() C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的ΔH_____0(填“>”或“<”),CH4的平衡转化率为________。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01 mol/(L·s)的平均速率增多,经t s后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>” 或“<”)T2,t=________s;
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的ΔH_____0(填“>”或“<”),CH4的平衡转化率为________。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01 mol/(L·s)的平均速率增多,经t s后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>” 或“<”)T2,t=________s;
②列式计算反应2CH4(g) ![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=__________________(用平衡分压代替平衡浓度计算,lg0.05=-1.3);
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=__________________(用平衡分压代替平衡浓度计算,lg0.05=-1.3);
③由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有__________________。
【答案】CaC2+2H2O―→Ca(OH)2+C2H2↑ +376.4 > 66.7% > 5 5.0×104 充入适量乙烯
【解析】
(1)碳化钙和水反应生成氢氧化钙和乙炔;
(2)根据盖斯定律来分析;
(3)①分解反应绝大多数为吸热反应;设出CH4的转化浓度,然后根据三段式,利用c(C2H4)=c(CH4)来解答;根据改变温度后,CH4的浓度升高来判断温度的变化;表示出变化后的CH4和C2H4的浓度,然后根据c(CH4)=2c(C2H4)来计算;②根据平衡常数表达式来计算;③甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,可以充入适量的乙烯。
(1)碳化钙和水反应生成氢氧化钙和乙炔,反应的化学方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)已知:①CH4(g)+2O2 (g)═CO2(g)+2H2O(l)△H=-890.3kJmol-1 .
②C2H2(g)+2.5O2(g)=2CO2 (g)+H2O(l)△H2=-1299.6kJ/mol
③2H2 (g)+O2(g)=2H2O(l)△H3=-571.6kJ/mol,
将①×4-②-③×3/2可得:2CH4(g)=C2H2(g)+3H2 (g)△H=(-890.3kJmol-1 )×4-(-1299.6kJmol-1)-(-571.6kJmol-1)×3/2=+376.4kJ/mol,故答案为:+376.4;
(3)①反应2CH4(g)=C2H4(g)+2H2(g)为分解反应,而分解反应绝大多数为吸热反应,故此反应为吸热反应;
设CH4的转化浓度为Xmol/L,可知:
2CH4(g)=== C2H4(g)+ 2H2(g)
初始浓度(mol/L):0.3 0 0
浓度变化(mol/L):X X/2 X
平衡浓度(mol/L):(0.3-X) X/2 X
根据c(C2H4)=c(CH4)可知:0.3-X=X/2
解得X=0.2mol/L;故CH4的平衡转化率=0.2/0.3×100%=66.7%;
改变温度后,CH4的浓度升高,即平衡左移,即温度应为降低,即T1>T2;
由于CH4以0.01mol/(Ls)的平均速率增多,经ts后再次达到平衡,故在tS的时间内,CH4的浓度变化为0.01tmol/L,根据浓度的该变量之比等于计量数之比,利用三段式来计算:
2CH4(g) == C2H4(g)+2H2(g)
初始浓度:0.1mol/L 0.1mol/L
浓度改变:0.01tmol/L 0.005tmol/L
平衡浓度:(0.1+0.01t)mol/L (0.1-0.005t)mol/L
由于c(CH4)=2c(C2H4),故有:0.1+0.01t=2×(0.1-0.005t),解得t=5
故答案为:>;66.7%;>;5;
②根据此反应的平衡常数表达式,将气体的平衡浓度换为平衡分压,即![]() ,故答案为:5×104;
,故答案为:5×104;
③甲烷裂解制乙炔有副产物乙烯生成,充入适量的乙烯,可抑制甲烷向乙烯的转化,从而提高甲烷制乙炔的转化率,故答案为:可以充入适量的乙烯。


科目:高中化学 来源: 题型:
【题目】以有机物A(含有苯环的烃,化学式C8H8)和CCl4为原料合成苯丙氨酸E的流程如下:

已知:烃分子中的氢原子被卤素原子取代所生成的衍生物叫做卤代烃,如CH3CH2Cl;卤代烃在NaOH水溶液加热条件下会水解,如:
CH3CH2Cl+NaOH![]() CH3CH2OH+NaCl
CH3CH2OH+NaCl
CH2ClCH2Cl+2NaOH![]() CH2OHCH2OH+2NaCl
CH2OHCH2OH+2NaCl
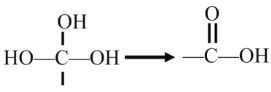 (该反应不需要条件就迅速转化)
(该反应不需要条件就迅速转化)
R-CH2CH2OH![]() R-CH=CH2+H2O
R-CH=CH2+H2O
(1)D→E的反应类型为_____________________。
(2)A的结构简式为________________________。
(3)有关D的叙述错误的是___________(填序号)。
a.能使酸性KMnO4溶液褪色 b.能与溴的CCl4溶液反应
c.能与甲醇发生酯化反应 d.能发生水解反应
(4)C→D反应的化学方程式为___________________________________。
(5)满足下列条件的E的同分异构体共有_________种。
①属于酯类;②苯环上只有两个对位取代基,其中一个为—NH2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应,X2++Z=X+Z2+,Y+Z2+=Y2++Z。这四种离子被还原成0价时,表现的氧化性强弱顺序为( )
A.R2+>X2+>Z2+>Y2+B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+D.Z2+>X2+>R2+>Y2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分:

(1)元素⑩原子结构示意图为__________.
(2)元素③④的第一电离能大小关系为_______(填化学用语,下同),原因是__________________。④-⑧中最高价氧化物对应水化物酸性最强的是_______.
(3)写出元素⑦的最高价氧化物与NaOH溶液反应的离子方程式_________。
(4)元素⑤ 与⑧ 元素相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是__________。
A.气态氢化物的挥发性和稳定性
B.两元素的电负性
C.单质分子中的键能
D.含氧酸的酸性
E.氢化物中X—H键的键长
F.两单质在自然界中的存在形式
(5)根据下列五种元素的第一至第四电离能数据(单位:KJ·mol﹣1),回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①T元素最可能是________(填“s”、“p”、“d”、“ds”等)区元素;
在周期表中,最可能处于同一主族的是_________.(填元素代号),
②下列离子的氧化性最弱的是______________。
A.S2+ B.R2+ C.U+ D.T3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。

下列推论不合理的是
A. 活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁为负极
C. 增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D. 利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的氢离子均减少
D.产生气泡的速度甲比乙慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是( )
A. 乙醇与溴化氢的水溶液共热:CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
B. 甲烷和氯气在光照条件下的反应:2CH4+Cl2![]() 2CH3Cl+H2
2CH3Cl+H2
C. 苯酚溶液中滴入NaOH溶液:H++ OH-![]() H2O
H2O
D. 苯酚钠溶液中通入少量CO2:CO2+ H2O + 2C6H5O-![]() 2C6H5OH + 2CO32—
2C6H5OH + 2CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制1.0mol/L的氢氧化钠溶液480mL。完成下列各题。
(1)应选择规格为__mL的容量瓶,该容量瓶上除注明规格外,还标有_____(选填编号)。
a.温度 b.浓度 c.压强 d.刻度线
(2)用电子天平称取_____gNaOH。
(3)将称好的氢氧化钠固体加_____将其溶解,待冷却后将溶液移入容量瓶中。
(4)用少量蒸馏水冲洗____2~3次,将洗液移入容量瓶中。
(5)向容量瓶内加水至接近刻度1~2cm处,改用胶头滴管小心地加水至______________。
(6)最后塞好瓶塞,摇匀,将配好的溶液移入__(选填编号)中并贴好标签。
a.  b.
b.  c.
c.  d.
d. 
(7)分析下列操作可能会对氢氧化钠溶液浓度造成的影响(填“偏高”、“偏低”或“无影响”)。
①氢氧化钠溶解后,未冷却即转移___。
②定容时仰视_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是水处理中重要的絮凝剂,以废铁屑为原料制备PFS的具体工艺流程如下:

下列说法错误的是
A. 步骤①,粉碎的目的是为了增大反应物接触面积,提高“酸浸”反应速率
B. 步骤④,加稀硫酸调节pH在一定的范围内,让Fe3+部分水解形成碱式盐
C. 步骤⑤,减压蒸发,有利于降低水的沸点防止产物分解
D. 步骤③,可以选择双氧水、氯气等氧化剂将Fe2+转化成Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com