
 (1)A.NH3 B.SO3 C.Cl2 D.BaSO4 E.酒精 F.CH3COONH4
(1)A.NH3 B.SO3 C.Cl2 D.BaSO4 E.酒精 F.CH3COONH4分析 (1)在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质;完全电离的属于强电解质,部分电离的为弱电解质,据此解答即可;
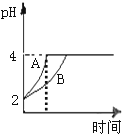
(2)从醋酸是弱电解质的角度分析,醋酸与Zn反应同时,电离出H+,pH变化较缓慢;
(3)25℃时、有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸用该NaOH溶液中和,需VbLNaOH溶液,则有VaL×10-amol/L=VbL×10b-14mol/L,即Va:Vb=10a+b-14,以此来计算;
(4)先根据酸、碱、盐确定PH大小;盐中阳离子相同,酸越弱,其盐的碱性越强,据此分析盐溶液的PH值大小;
(5)根据盐类的水解、弱电解质的电离分析;根据电荷守恒分析.
解答 解:(1)A.NH3是非解质; B.SO3是非解质; C.Cl2 是单质;D.BaSO4 是强电解质;E.酒精是非解质;F.CH3COONH4是强电解质;G.HClO是弱电解质;
故选DF;
(2)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2.
故答案为:<;
(3)25℃时、有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸用该NaOH溶液中和,需VbLNaOH溶液,则有VaL×10-amol/L=VbL×10b-14mol/L,即Va:Vb=10a+b-14,故答案为:10a+b-14;
(4))D、B、A、C是盐,E是碱,物质的量浓度相同的这几种溶液,盐的PH值小于碱的,所以E的PH值最大;D、B、A、C四种盐的阳离子相同,其阴离子相应的酸越弱,盐的pH值越大,醋酸的酸性>碳酸的酸性>偏铝酸的酸性,碳酸氢钠是酸式盐,碳酸钠是正盐,所以碳酸钠的pH值大于碳酸氢钠的,故相同物质的量浓度的这几种溶液的pH值由小到大的顺序是DBACE,故选:④;
(5)NH4Cl+NaOH=NH3.H2O+NaCl
反应前 0.01mol 0.002mol
反应 0.002mol 0.002mol 0.002mol 0.002mol
反应后0.008mol 0 0.002mol 0.002mol
所以溶液中的溶质是NH4Cl、NH3.H2O、NaCl;
NH4Cl是强酸弱碱盐能发生水解,所以存在平衡 体系; NH3.H2O和H2O都是弱电解质,部分电离,所以存在平衡体系:NH3•H2O?NH4++OH-;NH4++H2O?NH3•H2O+H+;H2O?H++OH-;Na+和Cl-不水解,所以其浓度不变;溶液中阴阳离子所带电荷相同,溶液中存在的离子为Na+、Cl-、NH4+、OH-、H+,
即n(Na+)+n(NH4+)+n(H+)=n(Cl-)+n(OH-),n(Na+)=0.002mol,n(Cl-)=0.01mol,
所以0.002mol+n(NH4+)+n(H+)=0.01mol+n(OH-),n(NH4+)+n(H+)=0.008mol+n(OH-),
所以n(NH4+)+n(H+)-n(OH-)=0.008mol,
故答案为:Na+;NH4+和H+.
点评 本题较为综合,考查电解质的概念、离子浓度大小比较,掌握弱电解质的电离平衡、盐类的水解、溶液中离子浓度大小的比较方法是解答的关键,题目难度中等.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有酸、碱稀溶液反应的中和热相等 | |
| B. | 用铜丝替代环形玻璃搅拌棒,测得△H偏高 | |
| C. | 烧杯之间用纸屑填充的目的是避免△H偏低 | |
| D. | 实验使用的定量仪器有量筒、玻璃棒、烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 尿酸酸性比盐酸弱 | B. | 尿酸钠的溶解度随温度升高而增大 | ||
| C. | 反应①为吸热反应,②为放热反应 | D. | 尿酸钠的熔点很低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,该溶液pH一定为14-a | |
| B. | 已知某温度Ksp(Ag2S)=6×10-30,Ksp(AgCl)=2×106,则2AgCl(g)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数y约为6.7×10-37 | |
| C. | 在25℃,将2amol•L-1的氨水与0.02mol•L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),则用含a的代数式表示NH3•H2O的电离常数K1=$\frac{1{0}^{-9}}{a-0.01}$ | |
| D. | 等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S?2H++S2- | B. | CH3COOH?H++CH3COO- | ||
| C. | NH3+H2O═NH${\;}_{4}^{+}$+OH- | D. | NaHCO3═Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol | B. | 0.2mol | C. | 0.225mol | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com