
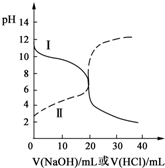
 25℃时,取浓度均为0.1000mol?L-1的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol?L-1NaOH溶液、0.1000mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1000mol?L-1的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol?L-1NaOH溶液、0.1000mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )| A、根据滴定曲线可得,25℃时 Ka(CH3COOH)≈Kb(NH3?H2O)≈10-5 |
| B、当NaOH溶液和盐酸滴加至20.00mL时,曲线Ⅰ和Ⅱ刚好相交 |
| C、曲线Ⅱ:滴加溶液到10.00 mL时,溶液中c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
| D、在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小 |
| c(H+)?c(CHC3OO-) |
| c(CH3COOH) |
| 10-3×10-3 |
| 0.1000-10-3 |
c(N
| ||
| c(NH3?H2O) |
| 10-3×10-3 |
| 0.1000-10-3 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
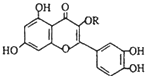 天然维生素P(结构如图,其中烃基R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )
天然维生素P(结构如图,其中烃基R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )| A、可以使酸性KMnO4溶液褪色 |
| B、分子中有三个苯环 |
| C、1mol维生素P可以和4mol NaOH反应 |
| D、维生素P与溴水反应时1mol维生素P可以消耗6mol Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯与苯都能使溴水褪色,但褪色原理不同 |
| B、1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol |
| C、溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化反应 |
D、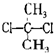 与 与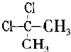 互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaAlO2溶液中滴加NaHCO3溶液:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- |
| B、碘水中通入适量的SO2:I2+SO2+2H2O═2HI+SO42-+2H+ |
| C、FeSO4溶液中滴加双氧水:2Fe2++2H2O2═2Fe3++O2↑+2H2O |
| D、Na2CO3发生水解反应:CO32-+2H2O═H2CO3+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=2与pH=1的CH3COOH溶液中,c(H+)之比为1:10 |
| B、1.0mol/L的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| C、仅含Na+、H+、OH-、CH3COO-离子的某溶液中可能存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、0.1mol/L的CH3COOH溶液中,由水电离出的c(H+)为1×10-13mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 80 | 100 | 120 |
| K | 1.80 | 2.76 | 3.45 |
| 时间(s) N(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 2.80 | a | 2.00 | c | d | 1.60 |
| n(NO2) | 0 | 0.96 | b | 2.08 | 2.40 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com