
【题目】草酸(H2C2O4)是一种二元弱酸。常温下,向H2C2O4溶液中逐滴加入NaOH溶液,混合溶液中lgX[X为c(HC2O4-)/c(H2C2O4)或c(C2O42-)/c(HC2O4-)]与pH的变化关系如图所示。下列说法一定正确的是( )
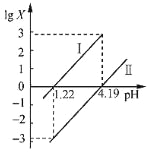
A. Ⅰ表示lgc(HC2O4-)/c(H2C2O4)与pH的变化关系
B. pH=1.22的溶液中:2c(C2O42﹣)+c(HC2O4﹣)>c(Na+)
C. 1.22<pH<4.19的溶液中:c(HC2O4﹣)>c(C2O42﹣)>c(H2C2O4)
D. pH=4.19的溶液中:c(Na+)=3c(HC2O4﹣)
【答案】AB
【解析】
二元弱酸草酸的K1=[c(HC2O4-)/c(H2C2O4)]×c(H+)>K2=[c(C2O42-)/c(HC2O4-)]×c(H+),当溶液的pH相同时,c(H+)相同,lgX:Ⅰ>Ⅱ,则Ⅰ表示lgc(HC2O4-)/c(H2C2O4)与pH的变化关系,Ⅱ表示lgc(C2O42﹣)/c(HC2O4-)与pH的变化关系;
二元弱酸草酸的K1=[c(HC2O4-)/c(H2C2O4)]×c(H+)>K2=[c(C2O42﹣)/c(HC2O4-)]×c(H+),当溶液的pH相同时,c(H+)相同,lgX:Ⅰ>Ⅱ,则Ⅰ表示lgc(HC2O4-)/c(H2C2O4)与pH的变化关系,Ⅱ表示lgc(C2O42﹣)/c(HC2O4-)与pH的变化关系。
A、根据分析可知,Ⅰ表示lgc(HC2O4-)/c(H2C2O4)与pH的变化关系,故A正确;
B、pH=1.22时,溶液呈酸性,则c(H+)>c(OH﹣),根据电荷守恒c(Na+)+c(H+)=c(HC2O4﹣)+2c(C2O42﹣)+c(OH﹣)可知,2c(C2O42﹣)+c(HC2O4﹣)>c(Na+),故B正确;
C、lgX为增函数,pH=1.22时,曲线Ⅰ中,lgX=lgc(HC2O4-)/c(H2C2O4)=0时,c(HC2O4﹣)=c(H2C2O4),曲线Ⅱ中lgX=lgc(C2O42﹣)/c(HC2O4-)=﹣3,103c(C2O42﹣)=c(HC2O4﹣)=c(H2C2O4);pH=4.19时,曲线Ⅰ中,lgX=lgc(HC2O4-)/c(H2C2O4)=3,c(HC2O4﹣)=103c(H2C2O4),曲线曲线Ⅱ中,lgX=lgc(C2O42﹣)=c(HC2O4-)=0,c(C2O42﹣)=c(HC2O4﹣)=103c(H2C2O4),所以1.22<pH<4.19的过程中,c(HC2O4﹣)逐渐增大,c(H2C2O4)逐渐减小,c(C2O42﹣)逐渐增大,则不一定满足c(C2O42﹣)>c(H2C2O4),故C错误;
D、pH=4.19时,曲线Ⅱ中c(C2O42﹣)=c(HC2O4﹣),溶质为等浓度的NaHC2O4、Na2C2O4,结合物料守恒看作c(Na+)>3c(HC2O4﹣),故D错误。


科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列判断正确的是
A. 标准状况下,2.24L苯中含有碳碳双键数为0.3NA
B. 6.4gS2、S4和S8的混合物中所含硫原子数为0.2NA
C. 1L0.1mol·L-1的氢碘酸中含碘化氢分子数为0.1NA
D. 60g乙酸与足量乙醇发生酯化反应时断裂的C-O键数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为__________________。N、O、S三种元素的第一电离能大小顺序为____________(填元素符号)。
②向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是________。
A.氨气极易溶于水,原因之一是NH3分子和H2O分子之间形成氢键的缘故
B.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
C.[Cu(NH3)4]SO4溶液中加入乙醇,会析出深蓝色的晶体
D.已知3.4 g氨气在氧气中完全燃烧生成无污染的气体,并放出a kJ热量,则NH3的燃烧热的热化学方程式为:NH3(g)+3/4O2(g)===1/2N2(g)+3/2H2O(g) ΔH=-5a kJ·mol-1
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的氧气变为臭氧(与SO2互为等电子体)。根据等电子原理,O3分子的空间构型为________。
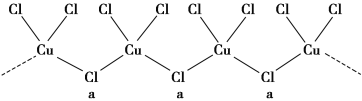
(3)氯与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子(含有一个配位键)的杂化轨道类型为____________________。
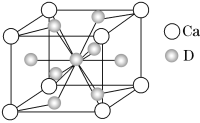
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,已知镧镍合金与上述Ca-D合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=______________________(填数值);氢在合金中的密度为________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 氯气溶于水:Cl2+H2O2H++Cl﹣+ClO﹣
B. 向FeSO4溶液中加入H2SO4酸化的KMnO4溶液:5Fe2++MnO4﹣+8H+═5Fe3++Mn2++4H2O
C. 向少量澄清石灰水中加入足量的NaHCO3溶液:Ca2++OH﹣+HCO3﹣═CaCO3↓+H2O
D. 用铜做电极电解NaCl溶液:2Cl﹣+2H2O![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用食盐晶体与浓硫酸在微热条件下反应制取氯化氢气体,反应的化学方程式为_____.
(2)氯化氢气体的发生装置应该选择装置_____(填装置的编号,下同).由于氯化氢气体有毒,所以实验室用装置D来收集氯化氢,则收集氯化氢时,气体从_____管(填a或b)进入.用水吸收多余的氯化氢气体时,应该选择装置_____,这是为了防止_____.

(3)要得到干燥的氯化氢气体,还需要在制取和收集装置之间插入一个干燥装置D,此时D中装入的液体应该是_____.
(4)为了比较盐酸溶液与氯化氢气体性质的不同之处,取两支试管,一支滴入2~3mL盐酸,另一支收集干燥的氯化氢气体并塞好橡皮塞,然后各放入一片干燥的蓝色石蕊试纸.观察到的现象是_____.再取两支试管,一支滴入2~3mL盐酸,另一支收集干燥的氯化氢气体并塞好橡皮塞,然后各放入一小块锌片.观察到的现象是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 18.00mL |
(1)准确配制0.20mol·L-1的氢氧化钠溶液250mL,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有____________________
(2)根据以上数据可以计算出盐酸的物质的量浓度为_____________mol·L-1.
(3)用0.20mol·L-1标准氢氧化钠溶液滴定待测盐酸溶液,滴定时左手控制碱式滴定管的玻璃球,右手不停摇动锥形瓶,眼睛注视 _______________,直到滴定终点。
(4)达到滴定终点的标志是_______________________________________________________
(5)以下操作造成测定结果偏高的原因可能是__________________。
A. 未用标准液润洗碱式滴定管
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应都有水参加,其中属于氧化还原反应,而水既不做氧化剂,又不做还原剂的是( )
A. Na2O + H2O = 2NaOH B. 2Na + 2H2O = 2NaOH + H2 ↑
C. C12 + H2O = HC1O + HC1 D. C + H2O ![]() CO + H2 ↑
CO + H2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为一种利用原电池原理设计测定O2含量的气体传感器示意图,RbAg4I5是只能传导Ag+的固体电解质。O2可以通过聚四氟乙烯膜与AlI3 反应生成Al2O 3和I2,通过电池电位计的变化可以测得O2的含量。下列说法正确的是( )
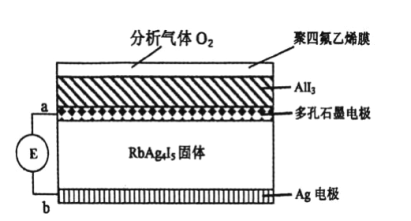
A. 正极反应为:3O2+12e-+4Al3+=2Al2O3
B. 传感器总反应为:3O2+4AlI3+12Ag=2Al2O3+12AgI
C. 外电路转移0.01mol电子,消耗O2的体积为0.56L
D. 给传感器充电时,Ag+向多孔石墨电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位,请回答问题:
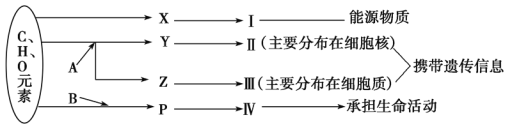
(1)图中X是___________,Ⅰ在小麦种子中主要是指________________________。
(2)图中Z是___________,使用甲基绿吡罗红混合染液染色,可使Ⅲ呈现_____色。
(3)图中P的结构通式为___________,填写出由P形成Ⅳ的结构层次_______________。
(4)Ⅱ和Ⅳ两者都有多样性,两者多样性的关系是前者___________后者。
(5)构成细胞的化合物中,随着年龄增长明显减少的主要是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com