
| A. | Na、Mg、Cu、Ag | B. | K、Al、Zn、Fe | C. | Na、Zn、Fe、Cu | D. | Cu、Ag、Fe、Na |
分析 ①测量A的硫酸盐溶液的pH,溶液的pH=7,则为强酸强碱盐;
②将B、C插入硫酸溶液中,C上无明显变化,用导线连接B、C,C电极上有气泡产生,C作正极,B作负极;
③电解C、D的盐溶液氧化性强的金属离子先析出.
解答 解:①测量A的硫酸盐溶液的pH,溶液的pH=7,则为强酸强碱盐,则A为活泼金属;
②将B、C插入硫酸溶液中,C上无明显变化,C与酸不反应,用导线连接B、C,C电极上有气泡产生,C作正极,B作负极,活泼性强的为负极,所以B的活泼性大于C;
③电解C、D的盐溶液氧化性强的金属离子先析出,D先析出,D的阳离子氧化性强,D单质的活泼性弱,即C的活泼性大于D;
所以金属性:A>B>C>D,而且C与酸不反应,选项中只有A符合.
故选A.
点评 本题考查了金属活泼性强弱的比较,题目难度不大,明确原电池工作的原理,判断出原电池的正极和负极,即可解答,注意一般情况下原电池负极的活泼性强于正极.


科目:高中化学 来源: 题型:解答题
 ;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式):OH-、H3O+.
;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式):OH-、H3O+. Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀.
Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
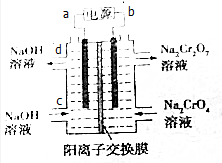 已知反应:2CrO42-+2H+?Cr2O72-+H2O.某科研小组用如图电解装置,由Na2CrO4溶液制取Na2Cr2O7溶液.下列有关叙述正确的是( )
已知反应:2CrO42-+2H+?Cr2O72-+H2O.某科研小组用如图电解装置,由Na2CrO4溶液制取Na2Cr2O7溶液.下列有关叙述正确的是( )| A. | CrO42-生成Cr2O72-的反应为非氧化还原反应,不能通过电解方法获得 | |
| B. | a为电源正极 | |
| C. | d口流出的NaOH溶液的浓度与c口通入的NaOH溶液的浓度相同 | |
| D. | Na+从右侧通过阳离子交换膜进入左侧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
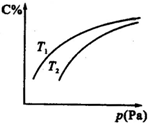
| A. | B一定为气体 | |
| B. | A一定为气体 | |
| C. | 若正反应方向△H<0,则T1>T2 | |
| D. | 压强增大时,混合气体的平均相对分子质量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2→NH3→NO→NO2→HNO3→NO | B. | Si→SiO2→H2SiO3→Na2SiO3 | ||
| C. | S→SO3→H2SO4→SO2 | D. | Al→Al2O3→Al(OH)3→NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑧ | B. | ②④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+H+ AlO2- SO32- | B. | NH4+ Al3+SO42-Cl- | ||
| C. | OH- K+ SO42- HCO3- | D. | Fe2+Na+ ClO-NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com