
| A. | 生活中常用的塑料制品及橡胶制品都为高分子材料 | |
| B. | 向牛奶中加入果汁会产生沉淀,这是因为酸碱发生了中和反应 | |
| C. | 节日焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
分析 A.塑料和橡胶都是高分子聚合物;
B.牛奶中含有蛋白质,加入果汁能使蛋白质凝聚而沉淀;
C.焰色反应为某些金属元素的性质;
D.浓盐酸易挥发,HCl和氨气反应冒白烟.
解答 解:A.塑料和橡胶都是高分子聚合物,属于高分子材料,故A正确;
B.因牛奶中含有蛋白质,加入果汁能使蛋白质凝聚而沉淀,且牛奶不是酸,则不是酸碱之间的反应,故B错误;
C.焰色反应为某些金属元素的性质,则节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩,故C正确;
D.浓盐酸易挥发,HCl和氨气反应生成氯化铵,现象为冒白烟,因此可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气,故D正确;
故选B.
点评 本题考查了蛋白质、材料、焰色反应、元素和化合物的有关知识,平时必须注重知识的积累,才能正确解答本类题型,注重化学与生活的联系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | B与A只能组成BA3化合物 | |
| B. | 第三周期中,D原子的原子半径最大 | |
| C. | A、B、C三元素不可能形成离子化合物 | |
| D. | E的氧化物对应水化物一定有强的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:A>C>B>D | B. | 原子半径:B>D>C>A | ||
| C. | 原子序数:C>B>D>A | D. | 简单离子半径:D>B>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
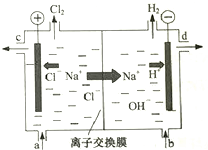 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、OH-、Br- | B. | H+、Fe2+、SO42-、CO32- | ||
| C. | K+、NH4+、CO32-、OH- | D. | Ca2+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 0.8 mol•L-1MgCl2溶液 | B. | 200 mL 0.4 mol•L-1AlCl3溶液 | ||
| C. | 50 mL 1.6 mol•L-1NaCl溶液 | D. | 25 mL 0.8 mol•L-1HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在图所示物质的转化关系中,D在常温下为无色无味的液体(反应条件均已省略).请回答下列问题:
在图所示物质的转化关系中,D在常温下为无色无味的液体(反应条件均已省略).请回答下列问题: .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com