
【题目】下表为九种主族元素在周期表中的位置:
A | |||||||
E | F | ||||||
B | D | I | G | ||||
C | H | ||||||
请回答下列问题:
(1)I元素的位置是第________周期,第______族。
(2)C、B、D 三种元素的金属性由强到弱的顺序为_______(填元素符号)。
(3)E、F两种元素对应的最简单氢化物的稳定性:________________ (填化学式)。
(4)C的单质与水反应的离子方程式为_______。
(5)用电子式表示A和G形成化合物的过程:____。
【答案】三 IVA K>Na>Mg H2O>NH3 2K+2H2O = 2K+ +2OH-+H2↑ ![]()
【解析】
由元素在周期表中的位置,可确定A为H、B为Na、C为K、D为Mg、E为N、F为O、G为Cl、H为Br、I为Si。同周期元素,从左往右,金属性依次减弱,非金属性依次增强;同主族元素,从上到下,金属性依次增强,非金属性依次减弱。
(1)I元素为Si,电子排布为2、8、4,在周期表中的位置是第三周期第IVA族。答案为:三;IVA;
(2)C、B、D 三种元素分别为K、Na、Mg,K、Na同主族且K在Na的下方,Na、Mg同周期且Mg在Na的右方,金属性由强到弱的顺序为K>Na>Mg。答案为:K>Na>Mg;
(3) E为N、F为O,非金属性O>N,非金属性越强,其氢化物稳定性越强,则两种元素对应的最简单氢化物的稳定性:H2O>NH3。答案为:H2O>NH3;
(4)C为K,其单质与水发生置换反应,生成KOH和H2,离子方程式为2K+2H2O = 2K+ +2OH-+H2↑。答案为:2K+2H2O = 2K+ +2OH-+H2↑;
(5)A为H,G为Cl,二者形成共价化合物HCl,则电子式表示的形成过程为![]() 。答案为:
。答案为:![]() 。
。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质互为同分异构体的是( )
A. CH3—CH3和CH3—CH2—CH3
B. 12C和14C
C. CH3—CH2—CH2—CH3和(CH3)2CHCH3
D.  和
和 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常见四种有机物的比例模型示意图。下列说法不正确的是( )

A. 甲不能使酸性高锰酸钾溶液和溴水均褪色
B. 乙可使酸性高锰酸钾溶液和溴水均褪色,且反应类型也相同.
C. 丙不能使酸性高锰酸钾溶液和溴水反应而褪色
D. 丁能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式正确的是( )
A.稀硝酸和过量的铁屑反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
B.向Ca(
HCO3)
2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.碳酸氢钠溶液水解的离子方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol FeS与b mol FeO投入V L c mol·L-1的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3-的量为( )
A.62(a+b) gB.186(a+b) gC.![]() molD.
molD.![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。通常状况下,X与W元素均能形成-1价的气态氢化物,Y为同周期主族元素中原子半径最大的元素,X、Z和W的原子最外层电子数之和为20。回答下列问题:
(1) W在元素周期表中的位置是__________。
(2)X和Y元素简单离子的半径较大的是________(填离子符号);Z和W元素气态氢化物的稳定性较弱的是__________(填化学式)。
(3)Y的氧化物中既含离子键又含共价键的是__________(用电子式表示)。
(4)Z的最高价氧化物对应水化物的浓溶液(过量)和氧化亚铜共热,反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯化硫(S2Cl2)是一种重要的有机合成氯化剂,实验室和工业上都可以用纯净干燥的氯气与二硫化碳反应来制取(CS2+3Cl2![]() CCl4+S2Cl2),其装置如下:
CCl4+S2Cl2),其装置如下:

(1)A装置中的离子反应方程式为______________。
(2) 一氯化硫(S2Cl2)常温下较为稳定,受热易分解,易被氧化,且遇水即歧化,歧化产物中不仅有淡黄色固体,而且还有两种气体,用NaOH溶液吸收该气体可得两种盐Na2SO3和NaCl。 写出一氯化硫与水反应的化学反应方程式______________。
(3)B装置的作用是___________________________________。
(4)D中冷凝管的冷水进水口为____(填“a”或“b”);实验过程中,需要先点燃A处酒精灯,通入氯气一段时间后方可向D中水槽里面加入热水加热,这样做的目的是______________。
(5)F装置是用来处理尾气氯气的,已知该吸收反应的氧化产物不仅有NaClO还有NaClO3,且n(NaClO)/n(NaClO3)=3/1,则该反应被还原的氯原子与被氧化的氯原子物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
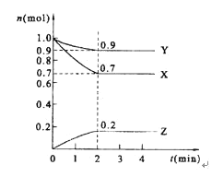
(1)反应物为____________生成物为_____________;
(2)由图中所给数据进行分析,该反应的化学方程式为__________________________;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=_________;
(4)当反应进行了3 min,该反应是否达到平衡___________(填“是”或“否”)。
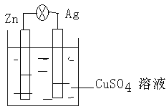
Ⅱ.在银锌原电池中,以硫酸铜为电解质溶液,锌为___________极,电极上发生的是___________反应(“氧化”或“还原”)。银为___________极,电极反应式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室需要 1.0 mol/L 的碳酸钠溶液 450 mL,利用碳酸钠晶体(Na2CO3·10H2O)来配制。下列说法正确的是
A. 应称取该碳酸钠晶体128.7 g
B. 取 100 mL 该溶液,向其中加入100 mL 水,所得溶液浓度为0.5 mol/L
C. 定容时俯视刻度线会引起配制溶液的浓度偏高
D. 定容、摇匀、静置后发现液面低于刻度线,应再补加少量水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com