
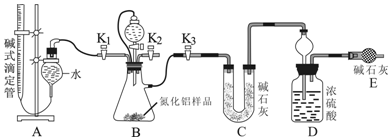
分析 用足量硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量;用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数,
(1)AlN溶于强碱溶液时会生成NH3;
(3)装置中残留部分氨气,打开K2,通入空气一段时间,排尽装置的氨气,被装置D完全吸收;
(4)①读取滴定管中气体的体积时,液面左高右低,气体的压强大于大气压,测定气体甲烷的体积偏小;
②根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,可求得AlN的质量分数.
解答 解:(1)根据题目信息AlN溶于强碱溶液时会生成NH3,化学方程式为AlN+NaOH+H2O=NaAlO2+NH3↑,故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;
(3)④装置中残留部分氨气,打开K2,通入空气一段时间,排尽装置的氨气,被装置D完全吸收,防止测定的氨气的质量偏小,
故答案为:通入空气一段时间;
(4)①读取滴定管中气体的体积时,液面左高右低,气体的压强大于大气压,测定气体甲烷的体积偏小,故答案为:偏小;
②氨气的质量为(z-y)g,物质的量为$\frac{z-y}{17}$mol,根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,所以AlN的质量为$\frac{z-y}{17}$mol×41g/mol=$\frac{41(z-y)}{17}$g,故AlN的质量分数为$\frac{\frac{41(z-y)}{17}}{x}$×100%=$\frac{41(z-y)}{17x}$×100%,故答案为:$\frac{41(z-y)}{17x}$×100%.
点评 本题考查物质含量的测定,为高考常见题型,题目涉及对实验原理与操作步骤的理解、化学计算、物质组成的测定等,难度较大,是对所需知识的综合运用,需要学生具有扎实的基础知识与分析问题、解决问题的能力,理解实验原理是解答的关键.


科目:高中化学 来源: 题型:选择题
| A. | 用加热法除去 Na2CO3 固体中的少量 NaHCO3 | |
| B. | Fe(OH)3 中含有少量 Al(OH)3 可用 NaOH 溶液除去 | |
| C. | Fe2+中含有少量 Fe3+,加入 Fe 单质 | |
| D. | 滴加 BaCl2溶液,形成白色沉淀,可以检验溶液中含有 SO 42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子的结构是由键角决定的 | |
| B. | 共价键的键能越大,共价键越牢固,由该键形成的分子越稳定 | |
| C. | CF4、CCl4、CBr4、CI4中C-X键的键长、键角均相等 | |
| D. | H2O分子中的共价键比HF分子中的共价键牢固 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 298K时,在20.0ml0.10mol/L氨水中滴入0.10mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol/L氨水的电离度为1.32%,下列有关叙述不正确的是( )
298K时,在20.0ml0.10mol/L氨水中滴入0.10mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol/L氨水的电离度为1.32%,下列有关叙述不正确的是( )| A. | 该滴定过程应该选择甲基橙作为指示剂 | |
| B. | M点对应的盐酸体积为20.0 mL | |
| C. | M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-) | |
| D. | N点处的溶液中pH<13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质和油脂一定条件下都能水解 | |
| B. | 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 | |
| C. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 | |
| D. | 与有机物 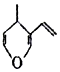 互为同分异构体,且能与NaOH溶液反应的化合物有7种 互为同分异构体,且能与NaOH溶液反应的化合物有7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com