
| A. | 构成原电池正极和负极的不一定是两种不同的金属 | |
| B. | 原电池是将化学能转化为电能的装置 | |
| C. | 在原电池中,电子流出的一极是负极,发生氧化反应 | |
| D. | 原电池放电时,电流的方向是从负极到正极 |
分析 A、原电池的正极和负极可能是两种不同的金属;
B、原电池是把化学能转变为电能的装置,原电池放电时,负极上失去电子发生氧化反应,正极上得电子发生还原反应;
C、原电池是把化学能转变为电能的装置,原电池放电时,负极上失去电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流下正极,
D、原电池中 电子流出的一端电极为负极,电流方向和电子流向相反.
解答 解:A、电极材料可由金属构成,也可由能导电的非金属和金属材料构成,故A正确;
B、原电池是把化学能转变为电能的装置,原电池放电时,负极上失去电子发生氧化反应,正极上得电子发生还原反应,故B正确;
C、原电池在在工作时其负极不断产生电子并经外电路流向正极,电子流出的一极为负极,失电子发生氧化反应,故C正确;
D、原电池放电,电流从正极流向负极,故D错误;
故选D.
点评 本题考查了原电池原理,难度不大,会根据得失电子判断化学反应类型、电极名称、电子流向,电流流向等,题目较简单.


科目:高中化学 来源: 题型:选择题

| A. | 已知图①是体系Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq) 中的c[Fe(SCN)2+]温度T的平衡图象.A点与B点相比,A点的c(Fe3+) 大 | |
| B. | 图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 | |
| C. | 图③表示电源X极为正极,U形管中为AgNO3溶液,则b管中电极反应式是:4OH--4e-=O2↑+2H2O | |
| D. | 图④表示分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数之差为2的两种元素不可能位于同一主族 | |
| B. | D-核外有36个电子,则元素D位于第四周期第ⅦA族 | |
| C. | 位于同一主族的甲乙两种元素,甲的原子序数为x,则乙的原子序数可能为x+4 | |
| D. | 位于同一周期的甲乙两种元素,甲位于第ⅠA族,原子序数为x,乙位于第ⅢA族,则乙原子序数可能为x+19 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
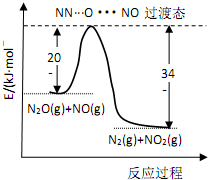 由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )
由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )| A. | 由图分析 N2O(g) 的能量一定高于 NO2(g)+N2(g) | |
| B. | 反应过程中没有发生化学键的断裂和化学键的生成 | |
| C. | 若生成 1mol N2(g),其△H=-139kJ•mol-1 | |
| D. | 由图可知 N2+NO2=N2O+NO△H=+139kJ•mol-1, 若使用催化剂还可以减小反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol | B. | 0.5 mol | C. | 0.6 mol | D. | 0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+4HCl(浓)$\frac{\underline{\;△\;}}{\;}$Cl2↑+Mn2++2Cl-+2H2O | |
| B. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至Ba2+刚好沉淀完全:Ba2++2OH-+H++${SO}_{4}^{2-}$+${NH}_{4}^{+}$═BaSO4↓+NH3•H2O+H2O | |
| C. | 向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:Ca2++${HCO}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| D. | 将标准状况下112mL氯气通入10mL、1 mol/L的溴化亚铁溶液中:2Br-+Cl2═2Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL量筒、烧杯、玻璃棒 | B. | 托盘天平、500mL容量瓶 | ||
| C. | 酒精灯、三角漏斗、导管 | D. | 胶头滴管、玻璃棒、烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com