
工业上可利用合成气(CO和H2的混合气体)生产甲醇.已知:CO(g)+2H2(g)⇌CH3OH(g)△H=﹣92.9kJ/mol一定条件下,该反应在一体积固定的密闭容器中达到平衡.下列说法正确的是()
A. 该反应的△S<0
B. 该反应在任何温度下均能自发进行
C. 向容器中充入少量He,平衡向正反应方向移动
D. 升高温度平衡向正反应方向移动
考点: 焓变和熵变;化学平衡建立的过程.
专题: 化学平衡专题.
分析: A、根据方程式中气体的计量数的变化判断;
B、化学反应能否自发进行,取决于焓变和熵变的综合判据;
C、向容器中充入少量He,容器体积不变,反应物浓度不变;
D、根据温度对平衡的影响分析.
解答: 解:A、已知:CO(g)+2H2(g)⇌CH3OH(g)△H=﹣92.9kJ/mol,由方程式中气体的计量数可知反应后气体物质的量减小,所以熵减小,即△S<0,故A正确;
B、化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H﹣T•△S<0时,反应能自发进行;已知△H<0,△S<0所以反应的在高温时能自发进行,故B错误;
C、向容器中充入少量He,容器体积不变,反应物浓度不变,正逆反应速率不变,所以平衡不移动,故C错误;
D、已知该反应△H<0,所以升高温度平衡逆移,故D错误;
故选A.
点评: 本题考查反应热与焓变,化学平衡移动,反应方向的判断,题目难度不大,注意自由能判据的应用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
火电厂利用燃煤发电,煤燃烧中的热化学方程式有:C(s)+O2(g)═CO2(g)△H1=﹣393.5kJ/molCO(g)+ O2(g)═CO2(g)△H2=﹣283kJ/mol C(s)+
O2(g)═CO2(g)△H2=﹣283kJ/mol C(s)+ O2(g)═CO(g)△H3=?下列有关说法中不正确的是()
O2(g)═CO(g)△H3=?下列有关说法中不正确的是()
A. CO的燃烧热为283 kJ/mol
B. 二氧化碳分解为一氧化碳和氧气的反应是吸热反应
C. △H3=△H2﹣△H1=110.5 kJ/mol
D. △H3=△H1﹣△H2=﹣110.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
热化学方程式C(s)+H2O(g) CO(g)+H2(g);△H=+131.3kJ/mol表示()
CO(g)+H2(g);△H=+131.3kJ/mol表示()
A. 碳和水反应吸收131.3kJ能量
B. 1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C. 1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D. 1个固态碳原子和1分子水蒸气反应吸热131.1kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
已知有热化学方程式:SO2(g)+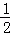 O2(g)═SO3(g)△H=﹣98.32kJ/mol现有4molSO2参加反应,当放出314.3kJ热量时,SO2的转化率最接近于()
O2(g)═SO3(g)△H=﹣98.32kJ/mol现有4molSO2参加反应,当放出314.3kJ热量时,SO2的转化率最接近于()
A. 40% B. 50% C. 70% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
体积相同的甲.乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2⇌2SO3,并达到平衡.在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率()
A . 等于p% B. 大于p% C. 小于p% D. 无法判断
. 等于p% B. 大于p% C. 小于p% D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)⇌2HI(g)△H<0反应中各物质的浓度随时间变化情况如图1:
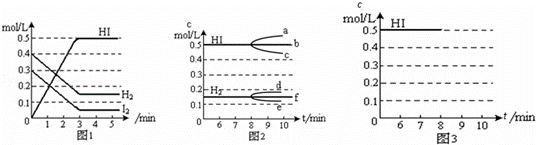
(1)该反应的化学平衡常数表达式为K= .
(2)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K (填写“增大”、“减小”或“不变”)HI浓度的变化正确的是 (用图2中a﹣c的编号回答)
②若加入I2,H2浓度的变化正确的是 ,(用图2中d﹣f的编号回答)
(3)反应达到平衡后,第8分钟时,若反应容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃、101kPa下,如图所示,石墨的燃烧热为393.5kJ/
mol,金刚石的燃烧热为395.0kJ/mol.下列说法或表达正确的是
()
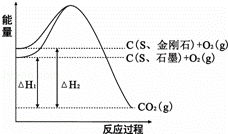
A. 金刚石比石墨稳定
B. C(s、石墨)=C(s、金刚石)△H=+1.5kJ/mol
C. △H1<△H2
D. 如果使用催化剂,△H1和△H2都变小
查看答案和解析>>
科目:高中化学 来源: 题型:
50mL 4mol•L﹣1的NaOH溶液密度为1.6g•cm﹣3,则
(1)此溶液的质量分数是 .
(2)此溶液加水稀释至500mL,再取出50mL,则此50mL溶液的物质的量浓度变是 所含溶质的质量是 g.
(3)此溶液能吸收标准状况下的Cl2的体积是 ,生成NaCl的质量是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com