
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.
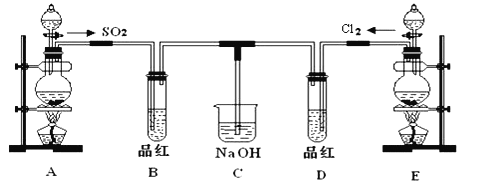
(1)实验室用装置A制备SO2某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是__________.
(2)实验室用装置E制备Cl2,其反应的化学方程式为__________;若有8mol的HCl参加反应,则转移的电子总数为__________.
(3)该装置中氢氧化钠溶液的作用是__________
(4)通气后B、D两个试管中的现象分别为B:________D:________.停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:______________D:___________.
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红的颜色_________.请你分析该现象的原因(用化学方程式表示)__________.
【答案】分液漏斗活塞未打开 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 4NA 尾气处理 褪色 褪色 变为红色 无变化 无变化 SO2+Cl2+2H2O = 2HCl+H2SO4
MnCl2+Cl2↑+2H2O 4NA 尾气处理 褪色 褪色 变为红色 无变化 无变化 SO2+Cl2+2H2O = 2HCl+H2SO4
【解析】
(1)依据分液漏斗使用方法和作用进行解答;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯气和氯化锰、水;
(3)SO2和Cl2均有毒,可以与氢氧化钠反应;
(4)SO2和氯水均具有漂白性,可漂白品红溶液;二氧化硫能够与有色物质化合生成无色物质,因而具有漂白性,该无色化合物具有不稳定性,受热容易分解;氯水因为具有强氧化性而漂白品红溶液,加热后无变化;
(5)氯水具有强氧化性可与二氧化硫反应。
(1)使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出,打开A的分液漏斗活塞后,漏斗中液体未流下,原因是:分液漏斗的玻璃塞未打开;
故答案为:分液漏斗的玻璃塞为打开;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯气和氯化锰、水,化学方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)SO2和Cl2均有毒,故C装置中氢氧化钠溶液的作用是:尾气处理,
故答案为:尾气处理;
(4)因二氧化硫可以漂白品红,氯气溶于水后也具有漂白性,则通气后B、D两个试管中的现象均是品红溶液褪色,又因为二氧化硫的漂白原理是其能够与有色物质化合生成无色物质,因而具有漂白性,但该无色化合物具有不稳定性,受热容易分解,加热后溶液恢复原来的红色;而氯水因强氧化性漂白的品红溶液,反应不可逆,故受热后现象无变化,
故答案为:褪色;褪色;变为红色;无变化;
(5)SO2和Cl2按1:1通入溶液中,发生氧化还原反应,其化学方程式为:SO2+Cl2+2H2O = 2HCl+H2SO4,即将两者按1:1同时通入品红溶液中,品红的颜色不会变化,
故答案为:无变化;SO2+Cl2+2H2O = 2HCl+H2SO4。


科目:高中化学 来源: 题型:
【题目】氮、氧、硫、磷是与生命活动密切相关的元素。回答下列问题:
(1)SO2分子的VSEPR模型名称是____。
(2)N、O、P三种元素第一电离能由大到小的顺序是________。
(3)气态氢化物氨(NH3)和膦(PH3)的键角较大的是(填化学式)____,原因是____。
(4)SCN-中C原子的杂化类型为___杂化,l mol SCN-中含π键的数目为____NA。
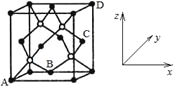
(5)晶胞有两个基本要素:
①原予坐标参数,表示晶胞内部各原子的相对位置。磷化硼是一种超硬耐磨的涂层材料,其晶胞结构如图所示,其中原子坐标参数A为(0,0,0);B为(1/2,1/2,0);D为(1,1,1)。则C原子的坐标参数为____。
②晶胞参数,描述晶胞的大小和形状。P原子与B原子的最近距离为a cm,则磷化硼晶胞的边长为____cm(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,将2molSO2和lmolO2充入10L恒容密闭容器中,发生反应 2SO2(g) +O2(g) ![]() 2SO3(g) △H=-196 kJmol-1,5min时达到平衡,测得反应放热166.6 kJ。下列说法错误的是
2SO3(g) △H=-196 kJmol-1,5min时达到平衡,测得反应放热166.6 kJ。下列说法错误的是
A. 05 min内,用O2表示的平均反应速率v(O2)=0.017 molL-1 min-1
B. ![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
C. 若增大O2的浓度,SO2的转化率增大
D. 条件不变,起始向容器中充入4 mol SO2和 2 mol O2,平衡时放热小于333.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使2molN2和6molH2混合发生反应:N2(g)+3H2(s)![]() 2NH3(g),(正反应为放热反应)下列说法错误的是
2NH3(g),(正反应为放热反应)下列说法错误的是
A. 升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变大
B. 升高平衡体系的温度(保持体积不变),混合气体的密度不变
C. 当反应达到平衡时,N2和H2的浓度比是1∶3
D. 当达到平衡时,充入氩气,并保持压强不变,平衡将逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在20 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )
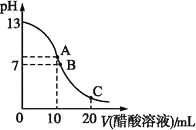
A. 在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B. 在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-)
C. 在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D. 在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。
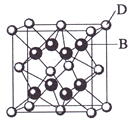
请回答:
(1)A元素的名称是 ;
(2)B的元素符号是 ,C的元素符号是 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
(3)E属元素周期表中第 周期,第 族的元素,其元素名称是 , 它的+2价离子的电子排布式为 :
(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合 物晶体的密度为ag·cm-3,则晶胞的体积是 (只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
A.ClO2是氧化产物
B.KClO3在反应中得到电子
C.H2C2O4在反应中被还原
D.1 mol KClO3参加反应有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
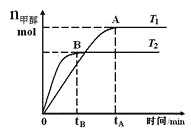
A. 平衡常数K=![]()
B. 该反应在T1时的平衡常数比T2时的小
C. CO合成甲醇的反应为吸热反应
D. 处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图示装置制取干燥的氨气:
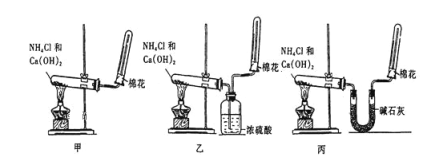
(1)实验室制备氨气化学方程式是_______________________________。
(2)工业制备氨气的化学方程式是_____________________________________________。
(3)若想制得干燥的氨气,应选择装置_______(填“甲”“乙”或“丙”),不能用乙装置干燥氨气的原因_______________________________(用化学方程式表示)。
(4)检验试管C中氨气收集满的方法是______________________。
(5)试管口放置棉花的作用是_________________________________________。
(6)某同学设计了如图装置收集氨气,下列说法不正确的是________(填字母)。
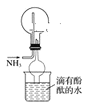
A.收集氨气的原理是向下排空气法
B.干燥管的作用是防止倒吸
C.当烧杯中的水变红时证明氨气已收集满
D.该装置会形成红色喷泉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com