
| A. | Cl2、HClO、HCl、H2O | |
| B. | Cl、Cl-、Cl2、H2O | |
| C. | Cl2、HCl、H2O、Cl-、H+、ClO-和极少量OH- | |
| D. | Cl2、HClO、H2O、Cl-、H+、ClO-和极少量OH- |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钠溶液中加入双氧水有氧气放出:ClO-+H2O2═O2↑+Cl-+H2O | |
| B. | 碳酸钙溶于稀醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 用稀硝酸洗涤做过银镜反应的试管:Ag+4H++NO3-═Ag++NO↑+2H2O | |
| D. | 苯酚钠溶液中通入少量CO2: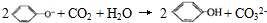 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定硫酸铜晶体中结晶水的含量,失水后的硫酸铜晶体置于空气中冷却后再称量质量 | |
| B. | 测定中和热实验中,所使用的氢氧化钠稀溶液的物质的量浓度稍大于盐酸 | |
| C. | 配制一定的物质的量浓度溶液的实验中,容量瓶内壁附有蒸馏水 | |
| D. | 用标准盐酸滴定未知浓度的氢氧化钠溶液,开始俯视读数,终点仰视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 50 | C. | 5×103 | D. | 1×104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
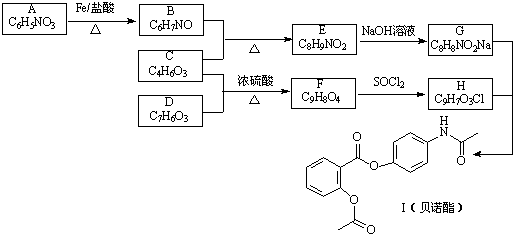

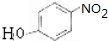 ,G
,G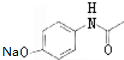 .
. .
. .
.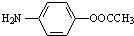 的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)
的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)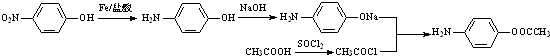 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验目的 | 实验编号 | 温度 | 金属铝的形态 | 酸及浓度 |
| 1.实验①和②探究盐酸浓度对该反应速率的影响 2.实验②和③探究探究温度对反应速率的影响 3.实验②和④探究金属规格(铝片,铝粉)对该反应速率的影响 4.①和⑤实验探究铝与稀盐酸和稀硫酸反应的差异 | ① | 25℃ | 铝片 | 4.0moL/L盐酸 |
| ② | 25℃ | 铝片 | 2.0moL/L盐酸 | |
| ③ | 35℃ | 铝片 | 2.0moL/L盐酸 | |
| ④ | 25℃ | 铝粉 | 2.0moL/L盐酸 | |
| ⑤ | 25℃ | 铝片 | 2.0moL/L硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com