
【题目】下表列出了①~⑩十种元素在周期表中的位置:
ⅠA | ||||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
请按要求回答下列问题。
(1)元素⑧对应的简单离子的结构示意图是____________。
(2)以上元素中,化学性质最不活泼的是 ____________(填元素符号)。
(3)写出元素⑤形成的单质在空气中燃烧的化学方程式______________________,这一反应是____________(填“吸热”或“放热”)反应。
(4)用电子式表示④与⑤形成的A2B型化合物的形成过程___________________________。
(5)在这些元素的最高价氧化物对应水化物中,酸性最强的化合物的分子式是:__________,与元素⑥的最高价氧化物对应水化物发生反应时的离子方程式为________________
(6)③的简单氢化物与③的最高价氧化物对应的水化物反应的生成物中含有的的化学键有____________________________。
【答案】 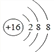 Ar 2Na +O2
Ar 2Na +O2 ![]() Na2O2 放热
Na2O2 放热 ![]() HClO4 Al(OH)3 +3H+= Al 3++ 3H2O 离子键、共价键
HClO4 Al(OH)3 +3H+= Al 3++ 3H2O 离子键、共价键
【解析】根据元素在周期表中的位置可知,①为H;②为C;③为N;④为O;⑤为Na;⑥为Al;⑦为P;⑧为S;⑨为Cl;⑩为Ar。
(1)元素⑧为S,是16号元素,简单阴离子的结构示意图为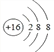 ,故答案为:
,故答案为: ;
;
(2)以上元素中,化学性质最不活泼的是Ar,故答案为:Ar;
(3)钠在空气中燃烧生成过氧化钠,反应的化学方程式为2Na +O2 ![]() Na2O2,物质的燃烧反应属于放热反应,故答案为:2Na +O2
Na2O2,物质的燃烧反应属于放热反应,故答案为:2Na +O2 ![]() Na2O2;放热;
Na2O2;放热;
(4)氧化钠的形成过程用电子式表示为![]() ,故答案为:
,故答案为:![]() ;
;
(5)元素的非金属性越强,最高价氧化物对应水化物的酸性越强,酸性最强的化合物的分子式是HClO4,与氢氧化铝反应的离子方程式为Al(OH)3 +3H+= Al 3++ 3H2O,故答案为:HClO4;Al(OH)3 +3H+= Al 3++ 3H2O;
(6)N的简单氢化物与N的最高价氧化物对应的水化物反应的生成物为硝酸铵,其中含有的的化学键有离子键、共价键,故答案为:离子键、共价键。


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】空气质量与我们的健康息息相关,目我国通过检测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2、和CO是其中3项中的污染物.
(1)上述3种气体直接排入空气后会引起酸雨的气体有(填化学式).
(2)处理酸雨市场采用NaClO2溶液作为吸收剂,可同时对烟气进行脱硫、脱硝,其中脱硫反应ClO2﹣+2SO32﹣2SO42﹣+Cl﹣ , 该反应的平衡常数K的表达式为;
(3)利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,写出电极A的电极方程式 , 当标况下有4.48L被处理时,通过电极B的电子数为 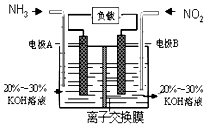
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同.
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)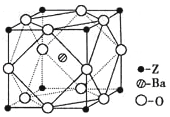
(1)化合物M的空间构型为 ,其中心原子采取 杂化;化合物N在固态时的晶体类型为
(2)R、X、Y三种元素的第一电离能由小到大的顺序为
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为 (写分子式)
(4)由R、X、Y三种元素组成的RXY﹣离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质.该反应的离子方程式为
(5)Z原子基态时的外围电子排布式为 ;Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是( )
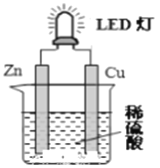
A. 铜片表面有气泡生成,且溶液中SO42-向该电极移动
B. 装置中存在“化学能→ 电能→ 光能”的转换
C. 如果将硫酸换成柠檬汁,导线中仍有电子流动
D. 如果将锌片换成铁片,电路中的电流方向不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水.向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝. 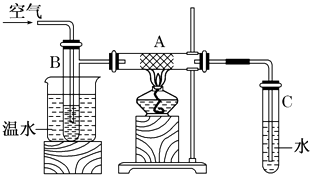
(1)撤去A处酒精灯后铜丝仍然能保持红热的原因是;
(2)反应后将试管C中的液体冷却,取出少量,加入到新制的Cu(OH)2悬浊液中,加热到沸腾可观察到现象是 , 写出反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),放入100mL浓度的H2SO4溶液中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀与加入NaOH溶液的体积的关系如右图所示,求:
(1)原溶液中c(H2SO4)= mol/L
(2)若a=2.3mL,计算各组分的质量:
m(Al2O3)= g;m(Fe2O3)= g;
(3)计算a值的取值范围: <a< .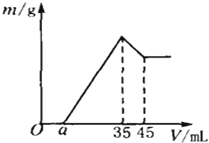
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应N2+3H2===2NH3的能量变化如图所示,该反应的热化学方程式是( )
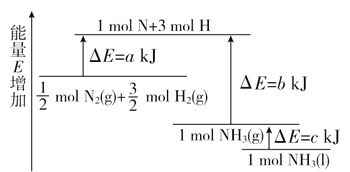
A. ![]() N2(g)+
N2(g)+![]() H2(g)=NH3(l) ΔH=(a-b-c) kJ/mol
H2(g)=NH3(l) ΔH=(a-b-c) kJ/mol
B. N2(g)+3H2(g)=2NH3(g) ΔH=2(b-a) kJ/mol
C. ![]() N2(g)+
N2(g)+![]() H2(g)=NH3(l) ΔH=(b+c-a) kJ/mol
H2(g)=NH3(l) ΔH=(b+c-a) kJ/mol
D. ![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g) ΔH=(a+b) kJ/mol
H2(g)=NH3(g) ΔH=(a+b) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两个电解槽中,A、B、C、D均为石墨电极。若电解过程中共有0.02 mol电子通过,下列叙述中正确的是( )
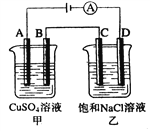
A. 甲烧杯中A极上最多可析出铜0.64g
B. 乙烧杯中滴入酚酞试液,D极附近先变红
C. 甲烧杯中B极上电极反应式:4OH--4e-=2H2O+O2↑
D. 烧杯中C极上电极反应式为:4H++4e-=2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些资料表明:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析Na2O2和NO2都有氧化性,根据化合价升降原则提出如下假设:
假设Ⅰ. Na2O2氧化NO2; 假设Ⅱ. NO2氧化Na2O2。
请回答下列问题:
(1)甲同学设计如图1所示实验装置:
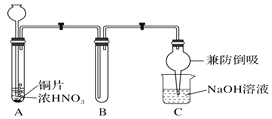
图1
①试管A中反应的离子方程式是___________________________________________________。
②待试管B中收集满气体,向试管B中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。甲同学据此认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,应在A、B之间增加一个装置,该装置的作用是__________________________________________________________________。
③乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的化学方程式是_____________________。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化,查阅资料知:
ⅰ) 2NO+Na2O2===2NaNO2;
ⅱ) 6NaNO2+3H2SO4===3Na2SO4+2HNO3+4NO↑+2H2O;
ⅲ)酸性条件下,NO或NO![]() 都能与MnO
都能与MnO![]() 反应生成NO
反应生成NO![]() 和Mn2+。
和Mn2+。
丙同学用图2所示装置(部分夹持装置略)探究NO与Na2O2的反应:
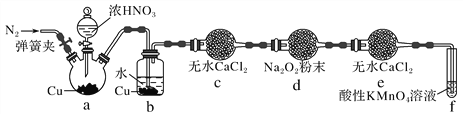
图2
①b装置中观察到的主要现象是__________________________________________________,f装置的作用是_________________________________________________________________。
②在反应前,先打开弹簧夹,通入一段时间N2,其目的是____________________________
③充分反应后,检验d装置中发生反应的实验是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com