
【题目】已知:还原性HSO3﹣>I﹣,氧化性IO3﹣>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.
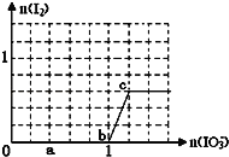
(1)a点时消耗NaHSO3的物质的量为_____mol,假设反应中无SO2逸出。
(2)从b点开始计算,当生成0.3mol I2时,转移电子数为_______个。
【答案】 1.2 0.5NA
【解析】还原性HSO-3>I-,所以首先是发生以下反应离子方程式:IO3-+3HSO3-═I-+3SO42-+3H+,继续加入KIO3,氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2。
(1)a点碘酸钾的物质的量是0.4mol,根据碘酸钾和亚硫酸氢钠的关系式知,消耗NaHSO3的物质的量=![]() ×3=1.2mol,故答案为:1.2;
×3=1.2mol,故答案为:1.2;
(2)根据图象知,b-c段内,碘离子部分被氧化生成碘单质,发生反应的离子方程式为IO3-+6H++5I-═3H2O+3I2,反应中转移5个电子。当生成0.3mol I2时,转移电子0.5mol,数目为0.5NA,故答案为:0.5NA。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】称取3.68g由BaCl2和NaOH组成的固体混合物一份。配成100 mL溶液,向其中逐滴加入一定浓度的H2SO4溶液,产生的沉淀质量(m)与加入H2SO4溶液体积(V)的关系如图。

(1)混合物中n(BaCl2):n(NaOH)为_________________。
(2)当反应沉淀达到最大量时,计算常温下溶液的PH= _________(混合前后溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在密闭容器里分别充入两种气体各1mol,在一定条件下充分反应后,恢复到原温度时,压强降低为开始时的1/4。则原混合气体可能是( )
A. H2和O2 B. HCl和NH3 C. H2和Cl2 D. CO和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是___________________。
(2)滤液1中加入H2O2溶液的目的是________________________________。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂为________________。
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式___________________________________。
(5)由滤液2生成Ce(OH)4的离子方程式_____________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:______________________________,相对于去除中性废水,其在去除酸性废水中的悬浮物时效率_________(填“增强”或“降低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Fe(s)+CO2(g)![]() FeO(s)+CO(g) K1 ①
FeO(s)+CO(g) K1 ①
Fe(s)+H2O(g)![]() FeO(s)+H2(g) K2 ②
FeO(s)+H2(g) K2 ②
H2(g)+CO2(g)![]() H2O(g)+CO(g) K3 ③
H2O(g)+CO(g) K3 ③
又知不同温度下,K1、K2值如下:
温度/℃ | K1 | K2 |
500 | 1.00 | 3.15 |
700 | 1.47 | 2.26 |
900 | 2.40 | 1.60 |
(1)若500℃时进行反应①,CO2起始浓度为2 mol·L1,2 min后建立平衡,则CO2转化率为_________,用CO表示的化学反应速率为____________。
(2)900℃时进行反应③,其平衡常数K3为___________(填具体数值),焓变ΔH_____0(填“>”“=”或“<”),若已知该反应仅在高温时正反应自发进行,则ΔS_____0(填“>”“=”或“<”)。
(3)下列图像符合反应②的是____________(填序号)。(图中v是速率,φ为混合物中H2的体积百分含量。)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知质量分数为98%的浓硫酸,密度为1.84g/mL,下列有关说法不正确的是
A. 该硫酸物质的量浓度为18.4mol/L
B. 取10mL该溶液,加等质量的水混合后,所得硫酸物质的量浓度小于9.2mol/L
C. 取10g该溶液,加入等体积水混合后,所得硫酸质量百分比浓度大于49%
D. 将该硫酸盛放在U型干燥管中,可用来干燥H2、SO2、H2S等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-物质结构与性质】氮的化合物在无机化工领域有着重要的地位。请回答下列问题:
(1)基态氮原子的价电子排布图为 。
(2)氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为 形,阳离子中氮的杂化方式为 。
(3)某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。工业上用氮气、氧化铝和碳在一定条件下反应生成CO和X (X的晶体结构如图所示),工业制备 X 的化学方程式为 。

(4)X晶体中包含的化学键类型为 (填字母标号)。
A .离子键 B .共价键 C .配位键 D .金属键
(5)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,其原因是 。
(6)若X的密度为ρg/cm3,则晶体中最近的两个Al 原子的距离为 cm (阿伏加德罗常数用 NA表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,浓硫酸既表现强氧化性,又表现酸性的是( )
A. 浓硫酸与氧化亚铁反应 B. 浓硫酸与木炭粉反应
C. 浓硫酸与氧化铜反应 D. 浓硫酸与氯化钠固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com