
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是()
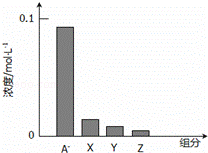
A. HA为强酸
B. 该混合液pH=7
C. 图中X表示HA,Y表示OH﹣,Z表示H+
D. 该混合溶液中:c(A﹣)+c(Y)=c(Na+)
考点: 酸碱混合时的定性判断及有关ph的计算.
专题: 电离平衡与溶液的pH专题.
分析: 一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,HA+NaOH=NaA+H2O,所得溶液中A﹣浓度小于0.1mol/L,说明在溶液中存在A﹣+H2O⇌HA+OH﹣,NaA水解,HA为弱酸,NaA溶液呈碱性,则c(OH﹣)>c(H+),一般来说,盐类的水解程度较低,则有c(A﹣)>c(OH﹣),所以有:c(Na+)=0.1mol/L>c(A﹣)>c(OH﹣)>c(HA)>c(H+),即X表示OH﹣,Y表示HA,Z表示H+,溶液中存在物料守恒为:c(Na+)=c(A﹣)+c(HA).
A.HA为弱酸;B.该混合液pH>7;C.X表示OH﹣,Y表示HA,Z表示H+;D.Y表示HA,溶液中存在物料守恒得到c(A﹣)+c(Y)=c(Na+).
解答: 解:一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,HA+NaOH=NaA+H2O,所得溶液中A﹣浓度小于0.1mol/L,说明在溶液中存在A﹣+H2O⇌HA+OH﹣,NaA水解,HA为弱酸,NaA溶液呈碱性,则c(OH﹣)>c(H+),一般来说,盐类的水解程度较低,则有c(A﹣)>c(OH﹣),所以有:c(Na+)=0.1mol/L>c(A﹣)>c(OH﹣)>c(HA)>c(H+),即X表示OH﹣,Y表示HA,Z表示H+,溶液中存在物料守恒得到:c(Na+)=c(A﹣)+c(HA).
A.一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,二者恰好反应:HA+NaOH=NaA+H2O,所得溶液为NaA溶液,溶液中中A﹣浓度小于0.1mol/L,说明在溶液中存在A﹣+H2O⇌HA+OH﹣,NaA水解,HA为弱酸,故A错误;
B.c(Na+)>c(A﹣),说明NaA水解,A﹣+H2O⇌HA+OH﹣,该混合液pH>7,故B错误;
C.HA是弱电解质,则有c(A﹣)>c(OH﹣),c(OH﹣)除了水解产生的还有水电离的,因此c(OH﹣)>c(HA),所以有:c(Na+)=0.1mol/L>c(A﹣)>c(OH﹣)>c(HA)>c(H+),即X表示OH﹣,Y表示HA,Z表示H+,故C错误;
D.溶液中存在物料守恒c(Na+)=c(A﹣)+c(HA),Y表示HA,得到c(A﹣)+c(Y)=c(Na+),故D正确;
故选D.
点评: 本题考查了酸碱混合溶液定性判断,根据酸的强弱结合物料守恒、电荷守恒分析解答,考查离子浓度大小比较、溶液PH值、盐类水解等,判断一元酸HA是弱酸为解题关键,题目难度中等.


科目:高中化学 来源: 题型:
下列实验操作中正确的是( )
|
| A. | 应使混合物中的水分完全蒸干后,才能停止加热 |
|
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
|
| C. | 分液操作时,下层液体从分液漏斗下口放出后再将上层液体从下口放出到另一个烧杯中 |
|
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列操作中,若以标准溶液滴定待测液,能造成中和滴定结果偏低的是()
A. 未用标准液润洗滴定管
B. 盛标准液的滴定管尖嘴部分有气泡未排出就开始滴定,滴定后气泡消失
C. 锥形瓶用蒸馏水洗,未用待测液润洗
D. 振荡时锥形瓶中液滴飞溅出来
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为 (溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)()
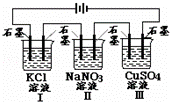
A. 13、7、1 B. 12、7、2 C. 1、7、13 D. 7、13、1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:25℃,Ksp[M(OH)2]=3.2×10﹣11,则此温度下M(OH)2饱和溶液的pH 等于()
A. 10 B. 10+lg2 C. 10+2×lg2 D. 10﹣2×lg2
查看答案和解析>>
科目:高中化学 来源: 题型:
若25℃时,CH3COOH的电离平衡常数Ka=1.8×10﹣5,则该温度下0.18mol/L的CH3COONa溶液的pH=9(CH3COONa水解程度很小,计算时可将CH3COO﹣的平衡浓度看成是CH3COONa溶液的浓度)
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y是元素周期表中ⅦA族中的两种元素,下列叙述中能说明X的非金属性比Y强的是( )
|
| A. | X原子的电子层数比Y原子的电子层数多 |
|
| B. | X的氢化物的沸点比Y的氢化物沸点低 |
|
| C. | X的气态氢化物比Y的气态氢化物稳定 |
|
| D. | Y的单质能将X从NaX的溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知汽车尾气无害化处理反应为2NO(g)+2CO(g)⇌N2(g)+2CO2(g),下列说法不正确的是()
A. 升高温度可使该反应的逆反应速率降低
B. 使用高效催化剂可有效提高正反应速率
C. 反应达到平衡后,NO的反应速率保持恒定
D. 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com