
中学阶段介绍的应用电解法制备的物质主要有三种:一是铝的工业制备、二是氯碱工业、三是金属钠的制备.下列关于这三个工业生产的描述中正确的是( )
|
| A. | 电解法制金属钠时,负极反应式:Na++e﹣=Na, |
|
| B. | 电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性 |
|
| C. | 在氯碱工业中,电解池中的阴极产生的是 H2,NaOH 在阳极附近产生 |
|
| D. | 氯碱工业和金属钠的冶炼都用到了NaCl,在电解时它们的阴极都是 C1一失电子 |
| 原电池和电解池的工作原理. | |
| 专题: | 电化学专题. |
| 分析: | A.电解熔融的NaCl制备金属Na,阴极上生成Na; B.电解熔融的氧化铝制备Al,需要对氧化物提纯; C.电解饱和食盐水时,NaOH在阴极生成; D.电解熔融的NaCl制备金属Na时阴极上生成Na,电解饱和食盐水时阴极产生的是H2. |
| 解答: | 解:A.电解熔融的NaCl制备金属Na,阴极上生成Na,则阴极反应式为Na++e﹣=Na,故A错误; B.电解熔融的氧化铝制备Al,需要对氧化物提纯,需要对氧化物溶解,再生成沉淀,则在提纯过程中应用了氧化铝或氢氧化铝的两性,故B正确; C.电解饱和食盐水时,NaOH在阴极生成,故C错误; D.电解熔融的NaCl制备金属Na时阴极上生成Na,电解饱和食盐水时阴极产生的是H2,则阴极都不是氯离子放电,故D错误; 故选B. |
| 点评: | 本题考查电解原理,明确电解原理、离子的移动方向、离子的放电顺序是解答本题的关键,题目难度不大. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
有机物X(C4H6O5)广泛存在于许多水果中,苹果、葡萄、西瓜、山楂内较多.该化合物具有如下性质:
①1 mol X与足量的金属钠反应产生1.5mol气体;
②X与醇、羧酸在一定条件下均生成具有香味的产物;
③X在一定程度下分子内脱水的产物(不是环状化合物)可与溴水发生加成反应.
根据上述信息,对X的结构判断正确的是( )
|
| A. | X中肯定有碳碳双键 |
|
| B. | X中可能有三个羟基和一个﹣COOR |
|
| C. | X中可能有三个羧基 |
|
| D. | X中可能有两个羧基和一个羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化规律不属于元素性质周期性变化规律的是( )
|
| A. | 第二周期N、O、F单质的沸点依次升高 |
|
| B. | 第三周期的P、S、Cl的氢化物的稳定性依次增强 |
|
| C. | 第三周期的P、S、Cl的最高价含氧酸的酸性依次增强 |
|
| D. | 第三周期的Na、Mg、Al的最高价氧化物的水化物的碱性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在一固定容积的密闭容器中发生如下反应:C(s)+CO2(g)⇌2CO(g),下列能说明该反应一定不是化学平衡状态的是( )
|
| A. | 混合气体的质量不再改变 |
|
| B. | 混合气体的分子数不再改变 |
|
| C. | 生成CO2(g)的速率与生成CO(g)的速率之比为1:2 |
|
| D. | 生成CO(g)的速率与生成CO2(g)的速率之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与人类生产、生活密切相关,下列有关说法不正确的是
A.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化
B.福尔马林可浸制标本,利用了其使蛋白质变性的性质
C.医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75%
D.绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
以乙炔或苯为原料可合成有机酸H2MA,并进一步合成高分子化合物PMLA。
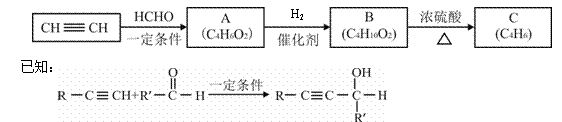 I.用乙炔等合成烃C。
I.用乙炔等合成烃C。
(1)A分子中的官能团名称是 、
(2)A的结构简式是
A的一种同分异构体属于乙酸酯,其结构简式是 。
(3)B转化为C的化学方程式是 ;
其反应类型是 反应。
II.用烃C或苯合成PMLA的路线如下。

已知:

(4)1 mol有机物H与足量NaHCO3溶液反应生成标准状况下的CO2 44.8 L,H有顺反异构,其反式结构简式是
(5)E的结构简式是
(6)G与NaOH溶液在加热条件下反应的化学方程式是
(7)H的核磁共振氢谱呈现 个吸收峰。
(8)聚酯PMLA有多种结构,写出由H2MA制PMLA的化学方程式(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
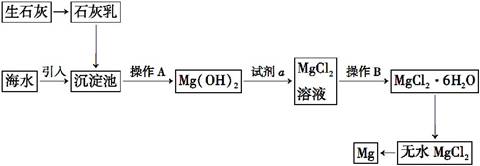
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是 ,
写出在沉淀池中反应的离子方程式
。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的 。
(3)操作A是 ,操作B是 。
(4)加入的足量试剂a是 (填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为
。
从考虑成本和废物循环利用的角度,副产物氯气可以用于 。
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
。
(7)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你 (填“同意”或“不同意”)该同学的想法,理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com