
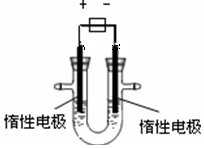
分析 (1)用惰性电极电解CuSO4溶液(如图的装置),电池的电极反应式阳极上是溶液中氢氧根离子失电子发生氧化反应生成氧气,阴极上溶液中铜离子得到电子发生还原反应;
(2)根据析出铜的质量计算转移电子数,根据两极转移电子数相等计算产生氧气的体积;
(3)用石墨电极电解CuSO4溶液,阴极铜离子放电,阳极氢氧根离子放电,然后根据析出的物质向溶液中加入它们形成的化合物即可.
解答 解:(1)用惰性电极电解CuSO4溶液(如图的装置),电池的电极反应式阳极上是溶液中氢氧根离子失电子发生氧化反应生成氧气,电极反应为:4OH--4e-=2H2O+O2↑,阴极上溶液中铜离子得到电子发生还原反应,Cu2++2e-=Cu,
故答案为:4OH--4e-=2H2O+O2↑;Cu2++2e-=Cu;
(2)阴极增重3.2g,应为铜的质量,n=$\frac{3.2g}{64g/mol}$=0.05 mol,
转移的电子为0.05mol×2=0.1mol,根据两电极转移的电子数目相等,则阳极转移的电子也为0.1mol,在阳极上生成氧气的物质的量为 $\frac{0.1mol}{4}$=0.025mol,放出气体在标准状况下的体积为0.025mol×22.4L/mol=0.56L;
故答案为:0.56L;
(3)CuSO4溶液存在的阴离子为:SO42-、OH-,OH-离子的放电能力大于SO42- 离子的放电能力,所以OH-离子放电生成氧气;
溶液中存在的阳离子是Cu2+、H+,Cu2+离子的放电能力大于H+离子的放电能力,所以Cu2+离子放电生成Cu;
溶液变成硫酸溶液;
电解硫酸铜的方程式为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2 Cu+O2 ↑+2H2SO4,
所以从溶液中析出的物质是氧气和铜,因为氧气和铜和稀硫酸都不反应,但和氧化铜反应,氧气和铜反应生成氧化铜,所以向溶液中加入氧化铜即可,故选C,
故答案为:C.
点评 本题考查了电解原理,能正确判断溶液中离子的放电顺序从而确定析出的物质是解本题的关键,题目难度中等.


 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | 上述各物质中能发生水解反应的有A、B、D、G | |
| B. | 根据图示可推知D为苯酚 | |
| C. | A的结构中含有碳碳双键 | |
| D. | G的同分异构体中属于酯且能发生银镜反应的只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 试管 | CaCO3的状态 | 盐酸的浓度 | 温度 |
| A | 块状 | 1mol•L-1 | 20℃ |
| B | 粉末状 | 1mol•L-1 | 20℃ |
| C | 块状 | 2mol•L-1 | 40℃ |
| D | 粉末状 | 2mol•L-1 | 40℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu和足量的稀硝酸反应产生4.48 L气体时,转移的电子数为0.6×6.02×1023 | |
| B. | 常温常压下,8.8 g CO2和N2O混合物中所含有的原子总数为0.6×6.02×1023 | |
| C. | 标准状况下,3.36 L己烷中含有的分子数目为0.15×6.02×1023 | |
| D. | 在1 L 0.2 mol/L的硫酸铁溶液中含有的三价铁离子数为0.4×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  在新型催化剂作用下利用太阳能使水分解的能量变化曲线 | |
| B. |  KNO3溶解度曲线,α点所示溶液为50℃时的不饱和溶液 | |
| C. |  常温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 | |
| D. |  10ml 0.01ml/L KMnO4酸性溶液与过量的0.1mol/L H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com