
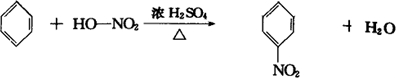

分析 (1)苯和浓硝酸浓硫酸混合物反应生成硝基苯和水发生取代反应;
(2)2-甲基-2-溴丁烷的水解反应水解生成2-甲基-2-丁烷醇;
(3)一定条件下,苯乙烯发生聚合反应生成聚苯乙烯;
(4)1-丙醇在浓硫酸作用下发生消去反应生成丙烯;
(5)甲醛发生银镜反应生成水、银、碳酸铵、氨气;
(6)乙醛和新制氢氧化铜发生氧化还原反应生成乙酸钠、氧化亚铜和水;
(7)乙酸乙酯和氢氧化钠反应生成乙醇和醋酸钠;
(8)氯乙烷与氢氧化钠的醇溶液共热发生消去反应生成乙烯和氯化钠,水.
解答 解:(1)苯和混酸反应生成硝基苯和水发生取代反应,反应的化学方程式为: ,
,
故答案为: ;
;
(2)2-甲基-2-溴丁烷的水解反应水解生成2-甲基-2-丁烷醇,方程式:CH3CBr(CH3)CH2CH3+NaOH$→_{△}^{水}$CH3COH(CH3)CH2CH3+NaBr;
故答案为:CH3CBr(CH3)CH2CH3+NaOH$→_{△}^{水}$CH3COH(CH3)CH2CH3+NaBr;
(3)一定条件下,苯乙烯发生聚合反应生成聚苯乙烯,反应方程式为: ,
,
故答案为: ;
;
(4)1-丙醇在浓硫酸作用下发生消去反应CH3CH2CH2OH$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O,
故答案为:CH3CH2CH2OH$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O;
(5)甲醛发生银镜反应方程式:HCHO+4[Ag(NH3)2]OH $\stackrel{水浴加热}{→}$ 4Ag↓+6NH3↑+(NH4)2CO3 +2H2O;
故答案为:HCHO+4[Ag(NH3)2]OH $\stackrel{水浴加热}{→}$ 4Ag↓+6NH3↑+(NH4)2CO3 +2H2O;
(6)在加热条件下,乙醛和新制氢氧化铜发生氧化还原反应生成乙酸、氧化亚铜和水,反应方程式为:CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O,
故答案为:CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O;
(7)乙酸乙酯在碱性条件下的水解方程式是:CH3COOC2H5+NaOH→CH3COONa+C2H5OH,
故答案为:CH3COOC2H5+NaOH→CH3COONa+C2H5OH.
(8)氯乙烷与氢氧化钠的醇溶液共热发生消去反应生成乙烯和溴化钠,水,反应的化学方程式为:CH3CH2Cl+NaOH$→_{△}^{醇}$CH2=CH2↑+NaCl+H2O,
故答案为:CH3CH2Cl+NaOH$→_{△}^{醇}$CH2=CH2↑+NaCl+H2O.
点评 本题考查有机物化学反应方程式的书写,为高频考点,把握常见有机物的性质及反应类型为解答的关键,注意有机反应条件,题目难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题
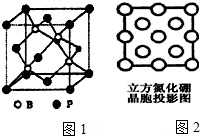 由N、B等元素组成的新型材料有着广泛用途.
由N、B等元素组成的新型材料有着广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种粒子,若核外电子排布完全相同,则其化学性质相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 一种微粒与另一种微粒的质子数和电子数均相等,它们可能是一种离子和一种分子 | |
| D. | 不存在两种质子数和电子数均相同的阳离子和阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下面给出了四种烃A、B、C、D的相关信息:
下面给出了四种烃A、B、C、D的相关信息: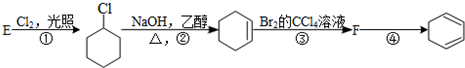
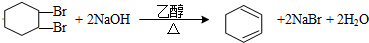 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
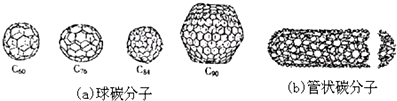
| A. | 金刚石和石墨的熔点肯定要比C60高 | |
| B. | 据估计C60熔点比金刚石和石墨要高 | |
| C. | 无论是球碳分子,还是管状碳分子、洋葱状碳分子,都应看作是碳的同素异形体 | |
| D. | C60的熔点低于C90 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
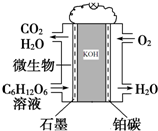 微生物燃料电池是利用微生物作为反应主体,将有机物的化学能转化为电能.如以葡萄糖溶液为例,其工作原理如图所示:
微生物燃料电池是利用微生物作为反应主体,将有机物的化学能转化为电能.如以葡萄糖溶液为例,其工作原理如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从 IIIB 族到 IIB 族 10 个纵行的元素都是金属元素 | |
| C. | 第ⅠA 族元素的金属性比第ⅡA 族元素的金属性强 | |
| D. | 在周期表里,主族元素所在的族序数等于原子核外电子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com