
| A. | CCl4 | B. | H2O | C. | He | D. | Al |
分析 He原子核外只有2个电子,Al原子最外层有3个电子,而水分子在H原子满足2电子结构,四氯化碳中C原子与氯原子之间形成1对共用电子对,C原子形成4个C-Cl键.
解答 解:A.四氯化碳中C原子与氯原子之间形成1对共用电子对,C原子形成4个C-Cl键,均满足电子结构,故A正确;
B.水分子中氧原子满足8电子结构,而H原子满足2电子结构,故B错误;
C.He原子核外只有2个电子,故C错误;
D.Al原子最外层电子数为3,故D错误.
故选:A.
点评 本题考查原子结构与共价键等,对共价键化合物中元素化合价绝对值与该元素原子最外层电子数之和等于8,化合物中该元素原子满足8电子结构,H原子一定不满足8电子结构.


科目:高中化学 来源: 题型:解答题
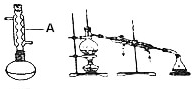 苯佐卡因(对氨基甲酸乙酯)常用于创面、溃疡面及痔疮的止痛,也是镇咳药退咳药的中间体,有关数据和实验装置图如下:
苯佐卡因(对氨基甲酸乙酯)常用于创面、溃疡面及痔疮的止痛,也是镇咳药退咳药的中间体,有关数据和实验装置图如下: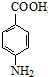 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$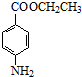 +H2O.
+H2O.| 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | -117.3 | 78.5 | 与水任意比互溶 |
| 对氨基苯甲酸 | 137 | 1.374 | 188 | 339.9 | 微溶于水 |
| 对氨基苯甲酸乙酯 | 165 | 1.039 | 90 | 172 | 难溶于水,易溶于醇、醛类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未用标准液润洗滴定管 | |
| B. | 盛标准液的滴定管尖嘴部分有气泡未排除就开始滴定 | |
| C. | 往锥形瓶中加待测液时,锥形瓶中有少许水 | |
| D. | 振荡时锥形瓶中液滴飞溅出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、Br2、I2的熔沸点依次升高 | |
| B. | 因为自然界中没有游离态的P元素,所以非金属性P>N | |
| C. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,一定无K+ | |
| D. | 已知FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某密闭容器盛有0.1molN2和0.3molH2,充分反应后,形成的N-H键数目为0.6NA | |
| B. | 若由CO2和O2组成的混合物共有NA个分子,则其中所含的氧原子数为2NA | |
| C. | 常温下,1L0.1mol/LNH4NO3溶液中的氢原子数为0.4NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体(标况下)时,电路中通过的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可做消毒剂 | |
| B. | 铝制品抛光车间须严格控制粉尘浓度以防爆炸 | |
| C. | 氧化铝可作耐火材料 | |
| D. | 金属铝无需经过特别处理就具有抗腐蚀能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
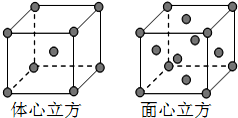 根据已学知识,请你回答下列问题:
根据已学知识,请你回答下列问题: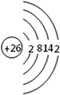 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com