

分析 (1)①先根据图2找出2、4、6min时刻时的氢气体积的变化量,再找出2、4、6min时刻时的速率与时间的关系,然后用平滑曲线描绘图象;
②根据该反应的反应热及溶液中氢离子的浓度判断.
(2)①原因Ⅱ:先确定Cl-对反应没有影响再猜测硫酸根离子的作用;
原因Ⅴ:根据原因Ⅳ提出与原因Ⅴ相反的观点;
②a中原来时快有硫酸根离子,后加入氯化锌,如果氯离子有促进作用,那么反应速率就比未加时快,以此证明原因Ⅲ是正确的;
b中中原来时快有氯离子,后加入硫酸锌,如果硫酸根离子有阻碍作用,那么反应速率比未加时慢,以此说明因Ⅲ是正确的.
解答 解:(1)①2、4、6min时刻时氢气体积的分别为10 mL、20mL、36mL,其平均反应速率分别为5 mL/min、7.5mL/min、6mL/min,然后标出速率与时间图象为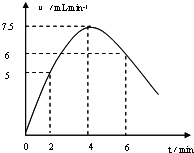 ,故答案为:
,故答案为: ;
;
②该反应是放热反应,随着反应的进行,放出的热量越多,溶液的温度越高,反应速率越大;随着反应的进行,溶液中氢离子的浓度逐渐减小,浓度越小,反应速率越小,
故答案为:镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大,4min后由于溶液中H+浓度降低,所以导致反应速率减小;
(2)①Ⅱ根据原因Ⅰ结合题意,提出与原因Ⅰ相反的观点为Cl-对反应没有影响,而SO42-对反应具有阻碍作用,
Ⅴ根据原因Ⅳ结合题意,提出与原因Ⅳ相反的观点为Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大),
故答案为:Cl-对反应没有影响,而SO42-对反应具有阻碍作用;Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大);
②a中原来时快有硫酸根离子,后加入氯化锌,如果氯离子有促进作用,那么反应速率就比未加时快,以此证明原因Ⅲ是正确的;
b中中原来时快有氯离子,后加入硫酸锌,如果硫酸根离子有阻碍作用,那么反应速率比未加时慢,以此说明因Ⅲ是正确的;
故答案为:ZnCl2;ZnSO4;反应速率加快; 反应速率减慢.
点评 本题考查应向化学反应速率的实验探究,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握实验原理,为解答该题的关键.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 2010年11月广州亚运会燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| C. | 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| D. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产生布朗运动 | B. | 产生丁达尔现象 | ||
| C. | 胶体微粒不能穿透半透膜 | D. | 分散质直径在10-7~10-9m之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁和足量氯气反应时,铁失去的电子数为0.2 NA | |
| B. | 22.4 L甲烷(CH4)所含的原子数为5 NA | |
| C. | 常温常压下,28 g氮气所含的原子数为2NA | |
| D. | 在20℃,1.01×105Pa时,11.2 L氧气所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | CH3CH2CH3 | B. | CH3CH2CH2OH | C. | CH3CH2CH2CH3 | D. | CH3CH2CHO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com