
| A.蒸馏水 | B.烧碱溶液 | C.纯碱溶液 | D.石灰石的悬浊液 |
 HCl+HClO。 由于产生的HCl会对平衡起抑制作用,所以制取的HCl浓度不大。B..Cl2+NaOH=NaCl+NaClO.不能得到HClO。C.由于酸性HCl>H2CO3>HClO ,所以会继续发生反应Na2CO3+ 2HCl=2NaCl+H2O+ CO2↑,使平衡正向移动,产生更多的HClO,因此比A好。但是溶液中可能有过量的Na2CO3,会导致HClO的含量低,而且纯度不高。D.在石灰石的悬浊液中存在沉淀溶解平衡CaCO3(s)
HCl+HClO。 由于产生的HCl会对平衡起抑制作用,所以制取的HCl浓度不大。B..Cl2+NaOH=NaCl+NaClO.不能得到HClO。C.由于酸性HCl>H2CO3>HClO ,所以会继续发生反应Na2CO3+ 2HCl=2NaCl+H2O+ CO2↑,使平衡正向移动,产生更多的HClO,因此比A好。但是溶液中可能有过量的Na2CO3,会导致HClO的含量低,而且纯度不高。D.在石灰石的悬浊液中存在沉淀溶解平衡CaCO3(s)  Ca2+(aq)+CO32-(aq), 由于在溶液中存在Cl2+H2O
Ca2+(aq)+CO32-(aq), 由于在溶液中存在Cl2+H2O HCl+HClO,且酸性HCl> H2CO3>HClO,所以会发生反应CO32-+2H+=CO2↑+H2O,使化学平衡和沉淀溶解平衡都正向移动,结果得到更多的产品,因为CaCO3难溶,所以不会引人过多的杂质。因此最好方法是将Cl2缓慢通入石灰石的悬浊液中。选项为D.
HCl+HClO,且酸性HCl> H2CO3>HClO,所以会发生反应CO32-+2H+=CO2↑+H2O,使化学平衡和沉淀溶解平衡都正向移动,结果得到更多的产品,因为CaCO3难溶,所以不会引人过多的杂质。因此最好方法是将Cl2缓慢通入石灰石的悬浊液中。选项为D.

科目:高中化学 来源:不详 题型:单选题
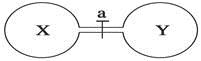
| 编号 | ① | ② | ③ | ④ |
| 气体X | HI | NH3 | H2 | NO |
| 气体Y | Cl2 | HCl | Cl2 | O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
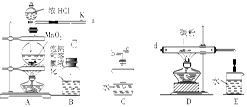
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③ | C.①⑤ | D.①③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将NaHCO3固体加入新制氯水中,有无色气泡产生(H+) |
| B.使红色布条褪色(HCl) |
| C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈红色(Cl2) |
| D.滴加AgNO3溶液生成白色沉淀(Cl-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 次数 | 1 | 2 | 3 |
| 滴定体积(mL) | 19.60 | 19.65 | 19.55 |
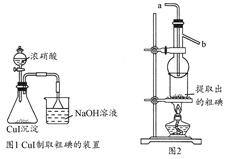
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
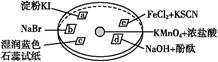
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com